1、填空题 饱和盐溶液W的电解产物发生下列系列反应。图中的每一方格表示有关的一种主要反应物或生成物(反应中加入或生成的水以及生成的其它产物已略去),其中A、B、C、D、E在常温下均为高中化学中常见气态物质,X和K是中学常见的金属单质,氧化物Y是一种比较好的耐火材料。


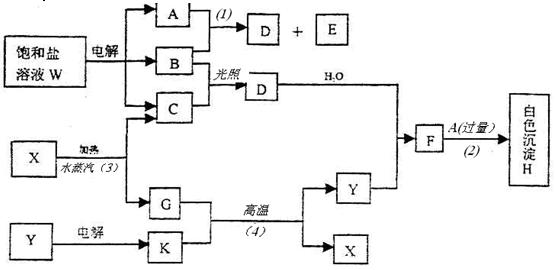
回答下列问题:


①W的名称是?,G的俗名是?。
②A分子的空间构型是?,键角是?°?′。
③反应(3)的化学方程式是?。
反应(4)的化学方程式是?。
④饱和盐溶液W电解的离子方程式是?。
⑤已知C的燃烧热为285.8kJ/mol。试写出C完全燃烧生成液态物质的热化学方程式?。
参考答案:

本题解析:略
本题难度:简单
2、推断题 现有A、B、C、D四种短周期元素, A分别与B、C、D结合生成甲、乙、丙三种化合物, 且甲、乙、丙3分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图:
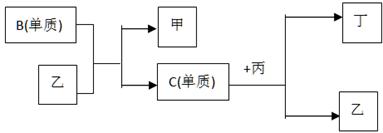
(1)写出B+乙→甲+C的化学反应方程式________________________________________。
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是_____。(填写序号)
① A? ② B? ③ C? ④ D
(3) 依据下列条件可以进一步确定上述第四种元素:
①甲与丙以及乙与丙均能够发生反应,②甲、丙、丁都是无色有刺激性气味的物质。
据此,请回答下列问题:
A.写出上述第四种元素在周期表中的位置?。
B.写出C+丙→乙+丁的化学反应方程式?。
参考答案:(1) 2F2+2H2O = 4HF+O2? (2) ④
(3) A. 第二周期第VA族
B.? 4NH3+5O2 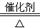 ?4NO+6H2O
?4NO+6H2O
本题解析:因为甲、乙、丙所含质子数相同,则可初步确定A是氢元素,考虑到B可置换C,可初步确定B是氟元素,C是氧元素,所以,D应该是碳元素或氮元素。如果确定B是氯元素,C是硫元素,则D为磷元素或硅元素,这与“C、D两元素形成丁”和“C单质与丙反应生成丁和乙”矛盾。 故A是H元素,B是F元素,C是O元素,D是N或C元素,甲是HF,乙是H2O,丙是NH3或CH4,丁是NO或CO2。
(1)由以上推断出的各个物质,方程式为2F2+2H2O = 4HF+O2。
(2)由以上推断出的各个物质,可知选④。
(3)依据题中所给的条件,判断出丙是NH3,丁是NO,故D是N元素。
A.N元素在周期表中的位置是第二周期第VA族。
B.氨的催化氧化方程式为4NH3+5O2 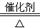 ?4NO+6H2O。
?4NO+6H2O。
点评:本题考查的是无机推断的相关知识,题目难度大,注意讨论法的应用,考查学生对基础知识的掌握程度。
本题难度:困难
3、填空题 (11分)下图是中学化学中一些常见的物质之间发生的一系列转化的框图(反应所需和所产生的水及某些反应条件已略),其中A、B、F、Y为黑色的固体,其中A、B、E、G、Y都含有同种VIA的元素,A和H、I含同种金属元素,但与H、I中该元素的化合价不同。E、G在常温常压下是气体,E有臭鸡蛋气味,G有刺激性气味。
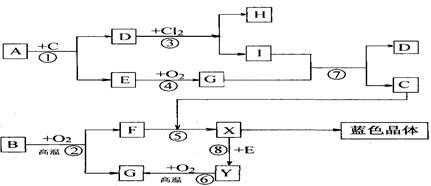
(1)写出下列物质的化学式:D____________,E____________。
(2)写出G通入I溶液发生反应⑦的离子方程式___________________________。
(3)以惰性电极电解X溶液的离子方程式_________________________________。
(4)试根据B、Y与氧气反应过程中的量的变化关系, 设计一个实验,不用实验室里的任何试剂,只用常用的仪器,区分B、Y两种物质(简要说明实验方法和实验结论)
设计一个实验,不用实验室里的任何试剂,只用常用的仪器,区分B、Y两种物质(简要说明实验方法和实验结论)
____________________________________________________________________
参考答案:(共11分)
(1)D为FeSO4(2分),E为H2S (2分)
(2)离子方程式2Fe3++SO2+2H2O=2Fe2++4H++SO42-(2分)
(3)离子方程式2Cu2++2H2O 2Cu+4H++O2↑(2分)
2Cu+4H++O2↑(2分)
(4)称一定 量的Cu2S和CuS充分燃烧,再称燃烧后的产物,若燃烧后的质量和反应物的质量相等,则被燃烧的物质是Cu2S,若燃烧后的质量比原来的反应物质量少,则被燃烧的物质是CuS。(3分)
量的Cu2S和CuS充分燃烧,再称燃烧后的产物,若燃烧后的质量和反应物的质量相等,则被燃烧的物质是Cu2S,若燃烧后的质量比原来的反应物质量少,则被燃烧的物质是CuS。(3分)
本题解析:略
本题难度:一般
4、填空题 (14分)A、B、C是常见短周期元素的单质,常温下D为无色液体 ,E是一种常见的
,E是一种常见的
温室气体。其转化关系如图所示(反应条件和部分产物略去)。试回答:
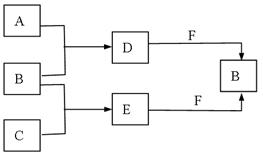
(1)F的电子式为?;
(2)少量的金属单质铝与D和F混合,写出反应的离子方程式?。
(3)D2mol、E 2mol与3molF在密闭容器中充分反应,所得固体成分为?;其相应的物质的量为?。
参考答案:(1)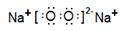
(2)2Na+2H2O=2Na++2OH-+H2↑? Al3++4OH-=AlO2-+2H2O
(3)Na2CO3和NaOH;2mol和2mol
本题解析:略
本题难度:简单
5、填空题 (8分)A、B、C、 D、 E、F六种元素的原子序数依次增大,原子序数均小于30。其中C原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;B原子的L电子层中未成对电子数与C相同,但还有空轨道;A,D的原子序数相差10,且A是最轻的元素;E原子最外层的p能级电子数是s能级电子数的两倍;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
请回答问题:
(1)A的名称是________
(2)B的元素符号是________;C的电子排布图(轨道排布式)为________;B和C形成化合物电子式为:_________
(3)D的元素符号为?,其原子结构示意图为?。
(4)E元素的符号为?,写出F原子基态的电子排布式为?。
参考答案:(1)氢;(2)C,1s22s22p4,:O::C::O: (3)Na,
(4)S,? 1s22s22p63s23p63d104s1
本题解析:由题意,得:C的L电子层排布为2s22p4,所以C为氧元素;则B的L电子层排布为2s22p2,所以B为碳元素;A是最轻的元素,所以A是氢元素;A,D的原子序数相差10,所以D是钠元素;E最外层电子排布为ns2np4,所以E为硫元素;F的外层电子排布为3d104s1,所以F为铜元素
本题难度:一般