1、选择题 14C是一种放射性同位素,在高层大气中由宇宙射线产生的中子或核爆炸产生的中子轰击14N可使它转变为14C。下列说法正确的是(?)
A.14C和14N互为同位素? B.14C和C60是同素异形体
C.146C核素中的中子数为8? D.14CO2?的摩尔质量为46
参考答案:C
本题解析:.14C和14N的质子数不同,不可能互为同位素,A不正确;由同一种元素形成的不同单质互为同素异形体,但14C属于核素,不是单质,B不正确;质子数+中子数=质量数,则中子数=14-6=8,选项C正确。摩尔质量的单位是g/mol,选项D不正确,答案选D。
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力,提高学生的应试能力和学习效率。该题的关键是明确同位素、核素和元素的概念和含义,特别是概念的内涵和外延。
本题难度:简单
2、填空题 A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中A、B单质是气体,C、D单质是固体。
 (1)写出以下元素的名称: B____________;C___________。
(1)写出以下元素的名称: B____________;C___________。
 (2)用电子式表示C2D的形成过程:___________。
(2)用电子式表示C2D的形成过程:___________。
 (3)由B、C两元素所形成的原子个数比为1:1的化合物属于__________(填“离子” 或“共价”)化合物,存在的化学键的种类有________(若有共价键需要写出具体的共价键类型),写出它与水反应的离子方程式____?。
(3)由B、C两元素所形成的原子个数比为1:1的化合物属于__________(填“离子” 或“共价”)化合物,存在的化学键的种类有________(若有共价键需要写出具体的共价键类型),写出它与水反应的离子方程式____?。
 (4)实验室常用A、B两元素所形成的原子个数为1:1的化合物来制备一种常见气体,写出实验室中用固体药品制备该气体的的化学方程式______________。
(4)实验室常用A、B两元素所形成的原子个数为1:1的化合物来制备一种常见气体,写出实验室中用固体药品制备该气体的的化学方程式______________。
(5)写出B的原子结构示意图?若一个B原子中有8个中子,写出B的原子符号?
(6)写出均由A、B、C、D四种元素组成的两种物质之间发生反应的离子方程式?
(7)由A、B两元素形成的单质在以铂作电极稀硫酸作电解液形成的燃料电池中,正极的电极方程式为?,若以氢氧化钾为电解液则负极的电极方程式为?。
参考答案:
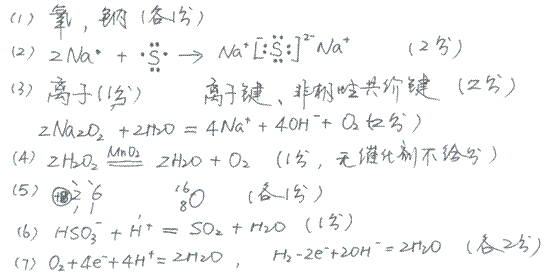
本题解析:略
本题难度:简单
3、填空题 (14分)现有6种短周期元素的性质或原子结构如下表:
元素编号
| 元素性质或原子结构
|
W
| 周期表中原子半径最小的元素
|
U
| 地壳中含量最多的金属元素
|
R
| 单质为空气的主要成分
|
T
| M层上有6个电子
|
X
| 最外层电子数是次外层电子数的2倍
|
Y
| 氢化物水溶液呈碱性
|
Z
| 元素最高正价是+7价
|
完成下列空白(涉及W、U、R、T、X、Y、Z时,用元素符号表示):
(1)元素T的原子共有?个电子;元素X的一种核素可测定文物年代,这种核素的
符号是?。
(2)用电子式表示:
①气态化合物XR2_________________;
②元素W、R形成的10电子分子的形成过程______________________________。
(3)用离子方程式表示:
①元素Y与元素W形成的离子YW4+与NaOH溶液共热的反应? _____;
②元素U的单质与NaOH溶液反应_______________________________________。
(4)元素Z与元素T相比,非金属性较强的是?,下列表述中能证明这一事实的
是?(填序号)。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(5)探寻物质的性质差异性是学习的重要方法之一。在T、X、Y、Z四种元素的最高价
氧化物的水化物中,化学性质明显不同于其他三种的是??(用分子式表示),
理由是?。
参考答案:(2、3小题各4分,其余每小题2分)
(1)16? ?
?
(2)
(3)NH4+ + OH- NH3↑+H2O? 2Al + 2OH- + 2H2O ="2" AlO2-+ 3H2↑
NH3↑+H2O? 2Al + 2OH- + 2H2O ="2" AlO2-+ 3H2↑
(4)Cl? b?(5)H2CO3? H2CO3是弱酸性(或非氧化性酸)
本题解析:略
本题难度:简单
4、填空题 (共13分)A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上八种元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式)____________,E、F、L所形成的简单离子的半径由大到小的顺序为(用离子符号表示)__?__ >?> ?。
(2)由L、I两元素可按原子个数比1:1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为?。固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:?。
(3)在10 L的密闭容器中,通入2mol LD2气体和1 mol D2气体,一定温度下反应后生成LD3气体,当反应达到平衡时,D2的浓度为0.01 mol·L-1,同时放出约177 kJ的热量,则平衡时LD2的转化率为?;该反应的热化学方程式为?;此时该反应的平衡常数K=?。
(4) 有人设想寻求合适的催化剂和电极材料,以C2、A2为电极反应物,以HCl—NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极反应式?;
参考答案:(共13分)(1)SiH4(1分)? S2-﹥? Na+?﹥ Al3+ (1分)
(2)  (2分)Na2O2+ S2-+2 H2O="=S+2" Na++4OH-?(2分)
(2分)Na2O2+ S2-+2 H2O="=S+2" Na++4OH-?(2分)
(3)90% (1分)? 2SO2 (g)+O2 (g)  2SO2 (g) ΔH=-196.7 kJ·mol-1?(2分)8100(2分)
2SO2 (g) ΔH=-196.7 kJ·mol-1?(2分)8100(2分)
(4) N2 + 6e-+ 8H+==2NH4+(2分)
本题解析:F的质子数比D多5,D的最外层电子数是F的2倍,则D应该是第二周期元素,F应该是第三周期元素。设F的最外层电子数是x,则D的最外层电子数就是2x,因此有关系式10+x-2-2x=5,解得x=3,则D是氧元素,F是Al。C、D、F三种元素的原子序数之和为28,因此C的原子序数是28-8-13=7,即C是氮元素。D与L属于同主族,且L的原子序数大于D的,因此L是S元素,I的原子序数最大,则I是氯元素。由于九种主族元素分布在三个不同的短周期,所以A是氢元素。A与E同主族,则根据E的原子数大于氧元素的可知,E是Na。G的原子序数只能是14或15,则根据B和G属于同主族且B的原子序数小于氮元素的可知,G不是P,应该是Si。则B是碳元素。
点评:本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。:
本题难度:一般
5、选择题 下列粒子:①质子 ②中子 ③电子,在所有原子中均含有的粒子是( )
A.①②③
B.仅①
C.①和③
D.①和②
参考答案:C
本题解析:在原子的组成中不一定都含有中子,但一定都含有质子和电子,答案选C。
点评:该题是常识性知识的考查,难度不大。主要是考查学生对原子组成的掌握情况,记住即可。
本题难度:简单