| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《物质的量》试题巩固(2019年最新版)(六)
参考答案:C 本题解析:根据阿伏加德罗定律知,在温度和密度都相同条件下,压强与摩尔质量呈反比。Ne的摩尔质量为20g/mol,H2的摩尔质量为2g/mol,O2的摩尔质量为32g/mol,所以三种气体的压强(p)从大到小的顺序是p(H2)>p(Ne)>p(O2),选C。 本题难度:一般 3、选择题 Mg、Zn、Al三种金属的混合物与足量的稀硫酸反应,生成2.8升氢气(S·T·P),原三种金属的物质的量之和可能是( ) |
参考答案:B
本题解析:
标准状况下为2.8L气体的物质的量为2.8L/22.4L·mol-1=0.125mol,
金属Mg、Zn与硫酸反应都表现为+2价,Al为+3价,利用电子转移守恒计算三种金属的物质量之和,
故有2n(Mg)+2n(Zn)+3n(Al)=2n(H2),
即n(Mg)+n(Zn)+1.5n(Al)=n(H2)=0.125mol,
0.125mol =n(Mg)+n(Zn)+1.5n(Al)> n(Mg)+n(Zn)+n(Al)
如全是Al,则金属最小为:0.125mol×2/3=0.0833mol,
故选B.
本题难度:一般
4、填空题 在标准状况下,空气中N2和O2的体积比约为4∶1,则N2和O2的物质的量之比为_________,空气的密度约为_________,空气的平均相对分子质量为_________。
参考答案:4∶1? 1.29 g·L-1? 29
本题解析:同温、同压下,两种气体的体积之比等于它们的分子数或物质的量之比,所以N2和O2的物质的量之比为4∶1。设n(N2)="4" mol,n(O2)="1" mol,则V="(1+4)mol×22.4" L·mol-1="112" L。
所以空气的密度:
ρ=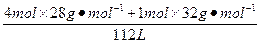 ≈1.29 g·L-1
≈1.29 g·L-1
其平均摩尔质量 ≈29 g·mol-1
≈29 g·mol-1
本题难度:简单
5、选择题 在20℃时一刚性容器内部有一不漏气且可滑动的活塞将容器分隔成左、右室两室。左室充入N2,右室充入H2和O2,活塞正好停留离左端1/5处(如右图a)然后点燃引爆H2和O2混合器,活塞先左弹(设容器不漏气),恢复至原来温度,活塞恰好停在中间(如右图b),水蒸气的体积可忽略,则反应前H2和O2的体积比可能是(? )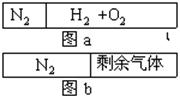
A.1︰1
B.1︰3
C.7︰1
D.5︰1
参考答案:A
本题解析:左右压强相等,气体的物质的量之比等于体积之比,设氮气的物质的量为1mol,则H2和O2的物质的量为4mol,反应后活塞正好停留在容器的中间.说明反应后左右气体的物质的量相等,则右室内剩余气体1mol,反应的H2和O2共3mol,根据2H2+O2 2H2O,可知反应的O2为1mol,反应的H2为2mol,若剩余的气体为H2,则反应前H2为3mol,O2为1mol,反应前H2和O2的体积比为3:1,若剩余的气体为o2,则反应前H2为2mol,O2为2mol,反应前H2和O2的体积比为1:1,故A项正确。
2H2O,可知反应的O2为1mol,反应的H2为2mol,若剩余的气体为H2,则反应前H2为3mol,O2为1mol,反应前H2和O2的体积比为3:1,若剩余的气体为o2,则反应前H2为2mol,O2为2mol,反应前H2和O2的体积比为1:1,故A项正确。
本题难度:一般
1、选择题 下列叙述正确的是
A.标准状况下,l mol任何物质的体积均为22.4 L
B.CH4的摩尔质量为16 g
C.1mol H2O的质量为18 g?mol-1
D.3.01×l023个SO2分子的质量为32 g
2、填空题 (1)44.8L某气体在标准状况下的质量为142g,该气体的摩尔质量为______;
(2)N2在标准状况下的密度为______g/L;
(3)在______molAL2(SO4)3中含0.3molSO42-,其中含Al3+______个.
3、选择题 V L硫酸铝溶液中含有Al3+mg,则溶液中SO42-的物质的量浓度为[? ]?
A.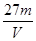 mol/L
mol/L
B.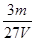 mol/L
mol/L
C.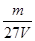 mol/L
mol/L
D.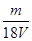 mol/L
mol/L
4、选择题 配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
A.所用NaOH已吸潮
B.定容前溶液未冷却
C.称量时砝码位置放错
D.向容量瓶加水时眼睛一直仰视液面
5、选择题 用NA表示阿伏加德罗常数的数值,下列说法错误的是(?)
A.1mol H2和O2的混合气体在标准状况下的体积约为22.4L
B.20℃、101kPa下,16g氧气中所含的氧原子数为NA
C.18g水所含的电子数为8NA
D.在标准状况下,0.5NA个氯气分子所占体积约是11.2L
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《难溶电解质.. | |