1、选择题 下列叙述正确的是
A.标准状况下,l mol任何物质的体积均为22.4 L
B.CH4的摩尔质量为16 g
C.1mol H2O的质量为18 g?mol-1
D.3.01×l023个SO2分子的质量为32 g
参考答案:D
本题解析:A、标准状况下,l mol任何气体的体积均为22.4 L,错误;B、摩尔质量的单位是g?mol-1 ,CH4的摩尔质量应为16 g?mol-1,错误;C、1mol H2O的质量应为18 g,错误;D、3.01×l023个SO2分子的物质的量为0.5mol,质量为32 g,正确。
本题难度:一般
2、填空题 (1)44.8L某气体在标准状况下的质量为142g,该气体的摩尔质量为______;
(2)N2在标准状况下的密度为______g/L;
(3)在______molAL2(SO4)3中含0.3molSO42-,其中含Al3+______个.
参考答案:(1)标准状况下44.8L该气体的物质的量为44.8L22.4L/mol=0.2mol,故该气体的摩尔质量为142g0.2mol=71g/mol,故答案为:71g/mol;
(2)标准状况下N2的密度为28g/mol22.4L/mol=1.25g/L,故答案为:1.25;
(3)含有0.3molSO42-的1molAL2(SO4)3物质的量为0.3mol3=0.1mol,由化学式可知n(Al3+)=23n(SO42-)=23×0.3mol=0.2mol,故Al3+数目为0.2mol×NAmol-1=0.2NA,
故答案为:0.1;0.2NA.
本题解析:
本题难度:一般
3、选择题 V L硫酸铝溶液中含有Al3+mg,则溶液中SO42-的物质的量浓度为[? ]?
A.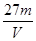 mol/L
mol/L
B.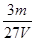 mol/L
mol/L
C.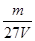 mol/L
mol/L
D.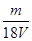 mol/L
mol/L
参考答案:D
本题解析:mg铝离子的物质的量是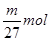 ,则根据硫酸铝的化学式可知,SO42-的物质的量为
,则根据硫酸铝的化学式可知,SO42-的物质的量为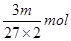 ,所以溶液中SO42-的物质的量浓度为
,所以溶液中SO42-的物质的量浓度为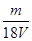 mol/L,答案选D。
mol/L,答案选D。
点评:该题是基础性试题的考查,难度不大。该题的关键是判断出两种离子之间的数量关系,然后依据有关的概念直接列式计算即可,有利于培养学生的逻辑推理能力。
本题难度:一般
4、选择题 配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
A.所用NaOH已吸潮
B.定容前溶液未冷却
C.称量时砝码位置放错
D.向容量瓶加水时眼睛一直仰视液面
参考答案:B
本题解析:
本题难度:一般
5、选择题 用NA表示阿伏加德罗常数的数值,下列说法错误的是(?)
A.1mol H2和O2的混合气体在标准状况下的体积约为22.4L
B.20℃、101kPa下,16g氧气中所含的氧原子数为NA
C.18g水所含的电子数为8NA
D.在标准状况下,0.5NA个氯气分子所占体积约是11.2L
参考答案:C
本题解析:考查阿伏加德罗常数的应用。18水的物质的量是18g÷18g/mol=1mol。由于水分子是由10个电子构成的,所以18g水中含有10mol电子,其个数是10NA,因此选项C不正确,其余都是正确的,答案选C。
本题难度:一般