1、实验题 (13分)茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素.某化学研究小组欲探究茶叶中钙元素的含量,设计了探究实验方案如下:(已知茶叶中的铝、铁元素对钙离子的测定有影响)
步骤1:称取500 g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将200mL 1 mol·L-1盐酸加入灰中搅拌、过滤、洗涤.
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6~7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30 min,加入7.95 g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,过滤后得到滤液和沉淀.
步骤3:将步骤2所得的滤液稀释至500 mL,取其中的20.00 mL溶液以甲基橙作指示剂,用0.1000 mol·L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为20.00 mL,计算结果.请回答下列问题:
步骤 1中:使茶叶灰化需要三角架、泥三角、酒精喷灯、_________、_________等仪 器.
器.
步骤2中:改用试剂________________来调节pH将更为方便.判断沉淀已经洗涤干净的方法是______________________________________________________________.
步骤3中:原茶叶中钙离子的质量分数为________________.若碳酸钠试剂不纯,且所含杂质不与Ca2+反应,则测得的钙离子的质量分数将__________(填下列序号之一:①偏小?②偏大?③不偏?④偏小或偏大或不偏)
参考答案:
步骤1:坩埚、坩埚钳
步骤2:氨水?取最后一次洗涤液少许于试管中,滴加CaCl2溶液, 若无沉淀产生,则已洗净.(其他合理答案均给分)
若无沉淀产生,则已洗净.(其他合理答案均给分)
步骤3: 0.4%(或0.004)? ④
本题解析:略
本题难度:简单
2、实验题 铜和稀硝酸在常温常压下反应,开始时反应非常慢,但是随着反应的进行,反应速率不断地加大。某校合作学习小组的同学拟探究影响其速率的主要因素。
(1)甲同学认为是生成的Cu2+对该反应起催起作用,欲验证其假设是否正确,其实验方法是_________________________________。
(2)乙同学依据铜和硝酸是放热反应,拟研究温度升高是否为该反应速度率不断加大的主要原因,实验结果如下
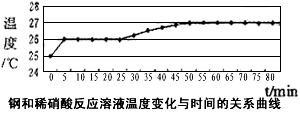
由此可得出的结论是:_____________________________。
(3)丙同学查阅文献,得知稀硝酸与铜反应,还原产物起始也是NO2,NO2对该反应起催化作用。通过下列装置验证。实验发现左侧3min后开始大量产生气泡,右侧40min内无明显变化。
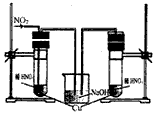
①氢氧化钠溶液的作用是_______________________。
②该学生设计在左侧加的是2mol·L-1 HNO3溶液,右侧加的是2.2mol·L-1硝酸。左侧浓度稍偏小,这样设计主要是考虑到______________________。
(4)丁同学与丙同学交流后,他将实验改进为:在试管中加入3mL2mol·L-1HNO3并放入铜片,然后加入几粒NaNO2晶体,发现只需1秒钟,铜片表面就开始产生气泡。由丁的实验可得出的结论是_________________________________。
参考答案:(1)取两去试管分别加入同浓度的稀硝酸和相同的铜片,在其中一支中加入少量硫酸铜晶体,比较两者开始产生气泡的时间
(2)80min内温度只上升了2℃,说明温度变化不是主要原因
(3)①吸收氮的氧化物,防止污染环境;②左侧通入NO2时,一部分NO2与水反应会生成硝酸,使硝酸浓度变大。
(4)NO2催化机理可能是在反应中得电子生成NO2-起催化作用(NO2-对该反应也能起催化作用)。
本题解析:
本题难度:困难
3、选择题 实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是

A.干燥Cl2
B.吸收HCl
C.制取Fe(OH)2沉淀
D.稀释浓H2SO4
参考答案:C
本题解析:略
本题难度:一般
4、选择题 用0.01 mol·L-1H2SO4滴定0.01 mol·L-1NaOH溶液,中和后加水至100 mL。若滴定时终点判断有误差:①多加了一滴H2SO4;②少加了一滴H2SO4(设一滴为0.05mL)。则①和②中[H+]之比的值是(?)。
A.10
B.50
C.5×103
D.104
参考答案:D
本题解析:多滴一滴硫酸c(H+)=(0.01×2×0.05×10-3)mol÷0.1L=1×10-5mol/L,则少滴一滴c(OH-)=1×10-5mol/L,c(H+)=1×10-9mol/L;故差为104倍
本题难度:一般
5、实验题 某学生用胆矾制取氧化铜,并研究氧化铜能否在氯酸钾实验中起催化作用。装置如图

实验步骤如下:
①称量ag胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至沉淀完全;
②把步骤①中的溶液和沉淀转移至蒸发皿中,加热至溶液中的沉淀全部变成黑色氧化铜为止;
③过滤、洗涤、干燥,称量所得固体质量为bg;
④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气。
请回答下列问题:
(1)上述各步骤操作中,需要用到玻璃棒的是__________(填写前面所述实验步骤的序号)。
(2)由胆矾制备氧化铜的产率(实际产量与理论产量的百分比)为____________ ×100%。
(3)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①~④后还应 该进行的实验操作是____(按实验先后顺序填写字母序号)。
a.过滤 b.烘干 c.溶解 d.洗涤 e.称量
(4)但有很大一部分同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你认为还应该进行的另一个实验是____________________________。
参考答案:(1)①②③ (2) (3)cadbe
(3)cadbe
(4)直接加热氯酸钾,观察生成氧气的快慢
本题解析:
本题难度:一般