1、选择题 在Na2S溶液中,c(Na+)与c(S2-)的大小关系( )
A.相等
B.c(Na+):c(S2-)=2:1
C.c(Na+):c(S2-)>2:1
D.c(Na+):c(S2-)<2:1
参考答案:C
本题解析:
本题难度:一般
2、选择题 相同温度时,有关①100 mL0.1mol/LNaHCO3、②100 mL0.1mol/LNa2CO3两种溶液的叙述不正确的是
[? ]
A. ①溶液中:c(CO32-)<c(H2CO3)
B. 溶液的pH:②>①
C. 溶液中的阴离子种类:②>①
D. ②溶液中:c(HCO3-)>c(H2CO3)
参考答案:C
本题解析:
本题难度:一般
3、填空题 甲醇是基础有机化工原料和新型清洁燃料,广泛用于制造各种燃料电池。工业上以甲烷和水蒸气为原料制备甲醇,反应过程如下。
反应Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) △H1
CO(g)+3H2(g) △H1
反应Ⅱ:CO(g)+2H2(g) CH3OH(g) △H2
CH3OH(g) △H2
(1)如图是反应1进行过程中的能量变化示意图。根据图象判断,升高温度,反应I的平衡常数将____________ (填“增大”、“减小”或“不变”)。反应I的逆反应的活化能为___________(用含E1、E2的表达式表示)

(2)已知在催化剂和一定压强下,反应?能自发进行。若保持容器容积不变,下列措施可增加该反应中CO转化率的是___________(填字母)。
A.适当降低温度
B.将甲醇从反应体系中分离出来
C.充入He,使体系总压强增大
D.按原比例再充入CO和H2
(3)一种甲醇燃料电池以多孔石墨为电极,一极通入甲醇蒸气,另一极通入氧气,电解 质溶液为4L 1 moI/L的KOH溶液。当有3 mol甲醇放电时,电解质溶液中各种离子的浓度由大到小的顺序为_________________
(4)下图甲是一种甲醇燃料电池的结构示意图,甲醇提供质子和电子,电子经外电路到达另一极与氧气反应,电池总反应为2CH3OH+3O2 2CO2+4H2O。
2CO2+4H2O。

①M电极的电极反应式为______________________________。
②以上述电池做电源,用乙图所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现Al电极附近逐渐变浑浊并有气泡逸出,原因是(用离子方程式表示):______________。Al电极应接燃料电池的___________(填“M”或“N”)极。
参考答案:(1)增大;E1-E2
(2)ABD
(3)c(K+)>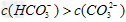 >c(OH-)>c(H+)
>c(OH-)>c(H+)
(4)①CH3OH+H2O-6e-=CO2+6H+;②Al+3HCO3-- 3e-=Al(OH)3↓+3CO2↑;N
本题解析:
本题难度:一般
4、填空题 常温下,用0.1000 mol/L NaOH溶液分别滴定20. 00 mL 0.1000 mol/L HCl溶液和20. 00 mL 0.1000 mol/L
CH3COOH溶液,得到2条滴定曲线,如下图所示。

(1)由A、C点判断,滴定HCl溶液的曲线是_________(填“图1”或“图2”);
(2)a=________mL;
(3)c(Na+) = c(CH3COO-)的点是___________________;
(4)E点对应离子浓度由大到小的顺序为__________________。
参考答案:(1)图1
(2)20.00
(3)D
(4)c(Na+) > c(CH3COO-) > c(OH-) > c(H+)
本题解析:
本题难度:一般
5、填空题 已知0.1mol?L-1CH3COONa溶液PH=8,按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外)______.
参考答案:0.1mol?L-1CH3COONa溶液PH=8,说明溶液呈碱性,原因是醋酸钠为强碱弱酸盐,水解呈碱性,在溶液中发生CH3COO-+H2O?CH3COOH+OH-,
则有c(Na+)>c(CH3COO-),
因呈碱性,则c(OH-)>c(H+),
一般来说,单水解程度较低,则c(CH3COO-)>c(OH-),
因发生CH3COO-+H2O?CH3COOH+OH-,且还存在水的电离,则c(OH-)>c(CH3COOH),
故有c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+),
故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+).
本题解析:
本题难度:一般