|
高中化学必备知识点《物质的组成》试题强化练习(2019年最新版)(二)
2019-06-28 21:29:43
【 大 中 小】
|
1、选择题 卤素单质可以参与很多化学反应, 如:NF3可由NH3和F2在Cu催化剂存在下反应直接得到;反应①: 2NH3+3F2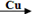 NF3+ 3NH4F NF3+ 3NH4F
利用“化学蒸气转移法”制备TaS2晶体; 反应②:TaI4(g)+S2(g)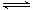 TaS2(s)+2I2(g)+Q kJ,Q>0 TaS2(s)+2I2(g)+Q kJ,Q>0
(1)反应①中:非金属性最强的元素原子核外有_________种不同运动状态的电子;该反应中的某元素的单质可作粮食保护气,则该元素最外层的电子有____________种自旋方向。
(2)反应①中:物质所属的晶体类型有________________________________;
并写出所有原子符合8电子稳定结构的化合物的电子式_______________________。
(3)反应②中:平衡常数表达式K=_____________________,若反应达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 ______________。
A.平衡常数K增大
B.S2的浓度减小
C.I2的质量减小
D.V(TaI4)逆 增大
| (4)反应②在一定温度下进行,若反应容器的容积为2 L,3 min后达到平衡,测得蒸气的质量减少了2.45 g,则I2的平均反应速率为 _________________。
(5)某同学对反应②又进行研究,他查阅资料,发现硫单质有多种同素异形体,可表示Sx,且在一定条件下可以相互转化,他认为仅增大压强对平衡是有影响的,则TaI4的平衡转化率会____________(填增大或减小),其原因是________________________ 。
参考答案:(1)9?、 2
(2)分子晶体、金属晶体、离子晶体?; ? ?
(3) ; A? B ; A? B
(4)0.00333或1/300mol/(L·min)
(5)该同学认为加压对TaI4平衡转化率会减小,原因是在S2可以转化为S4或S6或S8
2TaI4(g)+S4(g)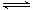 2TaS2(s)+4I2(g)加压使平衡向逆反应方向进行 2TaS2(s)+4I2(g)加压使平衡向逆反应方向进行
本题解析:
(1)在反应①中非金属性最强的元素是F,其核外电子排布是1s22s22p5.可见有9种不同运动状态的电子。在该反应中的某元素的单质可作粮食保护气,则该元素为N,其核外电子排布是1s22s22p3.在它的最外电子层有顺时针方向和逆时针方向两种不同的自旋方向。
(2)反应①中, NH3、3F2、NF3是由分子构成的分子晶体,Cu是由金属键构成的金属晶体,而NH4 F则是含有极性共价键和离子键的离子晶体。其中所有原子符合8电子稳定结构的化合物NF3的电子式是
(3)平衡常数是可逆反应达到平衡状态时各生成物浓度幂指数的乘积与个反应物浓度幂指数乘积的比。反应②中平衡常数表达式 。由于反应②的正反应是气体体积增大的放热反应。所以反应达到平衡后,保持其他条件不变,降低温度,根据平衡移动原理:降低温度,化学平衡向放热反应方:向移动。对该反应来说化学平衡向正反应方向移动,所以化学平衡常数增大。正确。B.由于降低温度,平衡正向移动,所以反应物的浓度减小。正确。C. 平衡正向移动,产生更多的I2,所以c(I2)增大,I2的质量增大。错误。D. 降低温度,无论是放热反应,还是吸热反应,反应速率都减小。错误。因此正确选项为AB。 。由于反应②的正反应是气体体积增大的放热反应。所以反应达到平衡后,保持其他条件不变,降低温度,根据平衡移动原理:降低温度,化学平衡向放热反应方:向移动。对该反应来说化学平衡向正反应方向移动,所以化学平衡常数增大。正确。B.由于降低温度,平衡正向移动,所以反应物的浓度减小。正确。C. 平衡正向移动,产生更多的I2,所以c(I2)增大,I2的质量增大。错误。D. 降低温度,无论是放热反应,还是吸热反应,反应速率都减小。错误。因此正确选项为AB。
(4)n(TaS2)=" 2.45" g÷245 g/mol=0.01mol.则生成I2的物质的量为0.02mol。所以I2的平均反应速率为V=Δc÷Δt=(0.02mol÷2L)÷3min=0.00333或1/300mol/(L·min).
(5)他认为仅增大压强对平衡是有影响的,则TaI4的平衡转化率会减小,其原因是在S2可以转化为S4或S6或S8。2TaI4(g)+S4(g)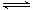 2TaS2(s)+4I2(g)加压使平衡向逆反应方向进行。 2TaS2(s)+4I2(g)加压使平衡向逆反应方向进行。
本题难度:一般
2、选择题 A、B为两短周期元素,A元素原子的L层比B元素原子的L层少3个电子,B原子核外电子总数比A原子核外电子总数多5,则A和B形成的化合物的化学式为(?)
A.A2B3?B.BA2? C.AB4?D.B3A2
参考答案:D
本题解析:本题考查根据电子层结构推断元素及其可能存在的化合价,由此判断可能的化学式。由题意知:A元素原子的L层比B元素原子的L层少3个电子,A原子核外电子总数比B原子核外电子总数少5个,那么肯定是B原子M层上多了2个电子,而且A元素原子的L层未排满,所以得两者的原子结构示意图,A: 、B: 、B: ,即A为N,B为Mg,A、B构成Mg3N2,即B3A2。 ,即A为N,B为Mg,A、B构成Mg3N2,即B3A2。
本题难度:一般
3、选择题 如图所示是短周期内八种元素单质的沸点与原子序数的关系图,下列说法正确的是

A.上述元素中,A的最高价氧化物对应的水化物酸性最强
B.简单离子的半径依A、B、C、D的顺序依次减小
C.工业上可通过电解H的熔融氯化物的方法制备H的单质
D.F的简单离子与C、D的简单离子构成的化合物都是盐
参考答案:B
本题解析:A单质沸点在4 000 ℃以上,短周期中主要是第ⅣA族的C或Si,考虑原子序数递增情况可确定A是单质C;B、C、D、E单质沸点在0 ℃以下,从而确定其都在常温下以气体存在。F接近1 000 ℃,而H的沸点约为2 500 ℃,分析Si以后的单质P、S均为分子晶体,故可确定H应考虑为Al或Si,而Si接近C,可进一步确定H可能为Al,则八种元素初步确定为:C、N、O、F、Ne、Na、Mg、Al。A、B的最高价氧化物对应的水化物酸性最强,错误:C、工业上采用电解熔融的H的氧化物的方法制备H的单质,错误;D、F的简单离子与C的简单离子构成的化合物不是盐,错误。?
本题难度:一般
4、选择题 几种短周期元素的原子半径及主要化合价如下表:
元素代号
| X
| Y
| Z
| W
| 原子半径/pm
| 160
| 143
| 70
| 66
| 主要化合价
| +2
| +3
| +5、+3、-3
| -2
|
下列叙述不正确的是
A.X、Y元素的金属性X<Y
B.X单质在空气中燃烧可以形成化合物X3Z2
C. X和Y均能与氧化物发生置换反应
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
参考答案:A
本题解析:根据元素的主要化合价和原子半径可知,X是镁,Y是Al,Z是N,W是O。同周期自左向右金属性逐渐减弱,所以金属性是镁大于铝,A不正确。镁可以在氮气中燃烧,生成氮化镁,B正确。钠和水反应,镁可以在CO2中燃烧,C不正确。氧气可以和氨气反应生成氮气,D正确。答案选A。
本题难度:一般
5、填空题 AB2离子化合物的阴、阳离子的电子层结构相同,1molAB2分子中含有54mol电子,且有下列反应:
①H2+B2 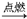 C C
②B2+X→Y+AB2+H2O
③Y+C→AB2+Z,已知Z有漂白作用
(1)写出下列物质的化学式:
AB?2,X?,
Y?,Z?。
(2)写出反应②的化学方程式?。
(3)写出反应③的离子方程式?。
参考答案:(1)CaCl2? Ca(OH)2? Ca(ClO)2? HClO
(2)2Cl2+2Ca(OH)2  ?CaCl2+Ca(ClO)2+2H2O ?CaCl2+Ca(ClO)2+2H2O
(3)ClO-+H+ ?HClO ?HClO
本题解析:AB2属离子化合物,A是+2价,B是-1价,由于A2+和B-具有相同的电子层结构,即离子的核外电子数相同,因1mol AB2分子中有54mol电子,则每个粒子有18个电子,可知A2+为Ca2+、B-为Cl-,根据提示可知:AB2为CaCl2,X为Ca(OH)2,Y为Ca(ClO)2,Z为HClO。
本题难度:简单
|