| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《化学平衡》试题特训(2019年最新版)(八)
参考答案:A 本题解析:由于次氯酸的酸性弱于碳酸的,所以向氯水中加入碳酸钙,则碳酸钙之和盐酸反应,促使平衡向正反应方向移动,所以次氯酸的浓度增大,A正确;B是增大氢离子的浓度,平衡向逆反应方向移动;氢氧化钠和次氯酸也是反应的,浓度降低,C不正确。稀释平衡向正反应方向移动,但浓度降低,因此正确的答案选A。 本题难度:一般 3、选择题 T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( ? ) |
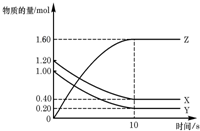
参考答案:D
本题解析:
本题难度:简单
4、简答题 苯乙烷(?
-C2H5)可生产塑料单体苯乙烯(
-CH=CH2),其原理反应是:
-C2H5(g)?

-CH=CH2(g)+H2(g);△H=+125kJ?mol-1.某温度下,将0.40mol?
-C2H5(g)充入2L真空密闭容器中发生反应,测定该容器内的物质,得到数据如下表:
| 时间/min | 0 | 10 | 20 | 30 | 40 n(  -C2H5)/mol 0.40 0.30 0.26 n2 n3 n(  -CH=CH2)/mol 0.00 0.10 n1 0.16 0.16 |




参考答案:(1)20min时,
-C2H5的物质的量为0.26mol,变化的物质的量为0.40mol-0.26mol=0.14mol,
根据方程式
-C2H5(g)?

-CH=CH2(g)+H2(g)可知,
生成
-CH=CH20.14mol,
? 
-C2H5(g)?

-CH=CH2(g)+H2(g)
起始:0.40mol? 0? 0
转化:0.16mol? 0.16mol? 0.16mol
平衡:0.24mol? 0.16mol? 0.16mol
平衡时:c(
-C2H5)=0.12mol/L,c(
-CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,
k=0.08mol/L×0.08mol/L0.12mol/L=0.053?mol?L-1,
故答案为:0.14;?0.053?mol?L-1;
(2)由化学方程式可知,增大压强,平衡向逆反应方向移动,则体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动,所以转化率增大,
故答案为:大;体系总压强一定时,水蒸气的分压越大,平衡体系的分压越小,平衡向气体体积增大的方向移动;
?(3)酸性氢氧燃料电池中,正极上氧气得电子发生还原反应,反应的电极方程式为O2+4H++4e-=2H2O,
故答案为:O2+4H++4e-=2H2O;
(4)在相同条件下,若最初向该容器中充入
-CH=CH2(g)和H2(g),假设在40min时达到上述同样的平衡状态,平衡时,c(
-C2H5)=0.12mol/L,c(
-CH=CH2)=0.08mol/L,c(H2)=0.08mol/L,起点(0,0.20)、终点在(40,0.08);苯乙烷曲线变化趋势在增大,弓向浓度轴,且起点(0,0)、终点(40,0.12),则图象为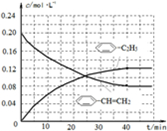
,故答案为:
.
本题解析:
本题难度:一般
5、选择题 在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
[? ]
A.Y2为0.2mol·L-1
B.Y2为0.35mol·L-1
C.X2为0.2mol·L-1
D.Z为0.4mol·L-1
参考答案:B
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《维生素与人.. | |