1、填空题 Fe(OH)2很不稳定,露置在空气中容易被氧化,发生反应的方程式为:?
为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用FeSO4晶体配制上述FeSO4溶液时我觉得还需加入?来防止Fe2+被氧化。
(2)除去蒸馏水中溶解的O2常采用?的方法。
(3)检验Fe3+的最佳试剂是?,简述其检验方法:?。
参考答案:4Fe(OH)2+O2+2H2O=4Fe(OH)3
(1)铁粉?(2)煮沸?(3)KSCN溶液;取待测液少量于试管中,滴入KSCN溶液,溶液变红,则原溶液中含有Fe3+(其他合理答案也行)
本题解析:Fe(OH)2很不稳定,露置在空气中迅速有白色变成灰绿色,最终变成红褐色,方程见答案,Fe2+不稳定,具有比较强的还原性,容易被氧化为Fe3+,常在保存FeSO4溶液时加入铁粉防止其被氧化;温度越高,气体的溶解度越小,加热煮沸后的蒸馏水其中溶氧量较低;Fe3+的检验常用KSCN溶液,溶液变为血红色。
本题难度:一般
2、实验题 草酸亚铁晶体(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。回答下列问题:
I.兴趣小组对草酸亚铁晶体的分解产物进行实验和探究。探究分解得到的固体产物中铁元素的存在形式。
(1)提出假设
假设一:___________;?假设二:全部是FeO ;?假设三:FeO和Fe混合物。
(2)设计实验方案证明假设三。
实验步骤
| 现象与结论
|
步骤1:向试管中加入少量固体产物,再加入足量?,充分震荡
| 若溶液颜色明显改编,且有?生成,则证明有铁单质存在
|
步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色
| ?
|
步骤3:去步骤2得到少量固体与试管中,滴加
?
| ?
|
?
限选试剂:稀盐酸、新制的氯水、0.1mol.L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
Ⅱ.兴趣小组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为:_______________
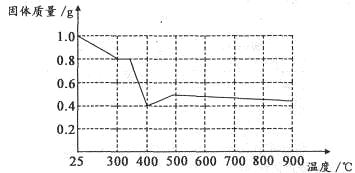
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g。某同学由此得出结论:假设二不成立。你是否同意该同学的结论,并简述理由:______________________。?
参考答案:Ⅰ:(1)全部是Fe
(2)
实验步骤
现象与结论
步骤1:硫酸铜溶液
(暗)红色固体
步骤3:过量HCl,静置,取上层清液,滴加几滴KSCN溶液,再滴加适量新制的氯水 ,充分振荡
若滴加适量新制的氯水后溶液呈红色,则证明有FeO
II、FeC2O4·2H2O FeO+CO↑+CO2↑+2H2O?
FeO+CO↑+CO2↑+2H2O?
不同意,实验没有在密闭容器中进行,FeO会被空气中的氧气进一步氧化,生成铁的其他氧化物
本题解析:
Ⅰ(1)根据物质的组成及后面的假设情况可以推知假设一为固体全部是Fe。(2)步骤一:若固体中含有FeO、Fe.则由于金属Fe是比较活泼的金属,能把活动性比它若的金属置换出来。所以可以向固体混合物中加入硫酸铜溶液,充分振荡后静置,若看到溶液的颜色变浅,同时产生暗红色的固体。就证明含有Fe单质。步骤三:将步骤而所得的的固体加入到足量的稀HCl中,发生反应:FeO+2HCl=FeCl2+H2O.充分振荡后静置,取上层清液,滴加几滴KSCN溶液,无现象,再滴加几滴新制的氯水 ,充分振荡,若看到溶液变为血红色,则证明固体中含有FeO.
II 根据质量守恒定律和电子守恒的规律可知FeC2O4·2H2O晶体受热分解的化学方程式为FeC2O4·2H2O FeO+CO↑+CO2↑+2H2O。根据方程式FeC2O4·2H2O
FeO+CO↑+CO2↑+2H2O。根据方程式FeC2O4·2H2O FeO+CO↑+CO2↑+2H2O可知1g晶体FeC2O4·2H2O分解产生的FeO的质量为0.4g.但由于分解反应在坩埚中敞口充分加热,没有在密闭的容器内进行。FeO有还原性,在加热时容易被空气中的氧气氧化为Fe2O3.所以固体的质量总大于0.4g.因此不能由此得到结论说假设二不成立。3+的检验、方程式的书写的知识。
FeO+CO↑+CO2↑+2H2O可知1g晶体FeC2O4·2H2O分解产生的FeO的质量为0.4g.但由于分解反应在坩埚中敞口充分加热,没有在密闭的容器内进行。FeO有还原性,在加热时容易被空气中的氧气氧化为Fe2O3.所以固体的质量总大于0.4g.因此不能由此得到结论说假设二不成立。3+的检验、方程式的书写的知识。
本题难度:一般
3、选择题 往FeCl3溶液中加入KSCN溶液,溶液的颜色是
A.无色
B.白色
C.红色
D.蓝色
参考答案:C
本题解析:三价铁离子的检验,可以加入KSCN,显红色。
本题难度:简单
4、填空题 (1)向FeCl3溶液中加入a g的铜粉,搅拌使之全部溶解,溶液中一定有的阳离子是_________。可能有的阳离子是?。发生反应的离子方程式为?;再向其中加入 b g铁粉,充分反应后过滤得滤渣c g,可能发生反应的离子方程式为?。若已知 a>b>c,则 c克滤渣是_________。
(2)鉴别Na2SO3溶液和稀H2SO4。请按要求完成下表:
步骤
| 操作
| 现象及结论
|
1
| 用甲、乙两支试管分别取两种溶液各少许。
| ?
|
2
| 用胶头滴管向甲试管中逐滴滴加BaCl2溶液至过量。
| ?
|
3
| ?。
| ?,则甲是?,乙是?。
?,则甲是?,乙是?。
|
?
说明:第3步不能使用其他任何仪器(包括胶头滴管)和试剂。
参考答案:(12分)
(1)Fe2+、Cu2+?Fe3+?Cu+2Fe3+=2Fe2++Cu2+?
2Fe3+ + Fe= 3Fe2+?、 Fe+ Cu2+= Fe2+ + Cu?Cu
(2)将乙试管中溶液逐渐倒入甲试管,边加边振荡?有气泡产生? Na2SO3溶液?稀H2SO4?先无气泡产生,后来有刺激性气味气体放出 ?稀H2SO4? Na2SO3溶液
本题解析:(1)氯化铁溶液能氧化铜,为了使之完全溶解,氯化铁溶液可能过量;由于Cu+2Fe3+=2Fe2++Cu2+,则溶解铜后的溶液中一定含有的金属阳离子为Fe2+、Cu2+,可能有的是Fe3+;由于氧化性:Fe3+ >Cu2+>Fe2+,则加入一定量的铁粉时,先发生的反应为2Fe3+ + Fe= 3Fe2+,铁离子被还原后,过量的铁粉还能再发生反应Fe+ Cu2+= Fe2+ + Cu,由于a>b>c,说明最终溶液中金属阳离子一定含有Fe2+、Cu2+,因此滤渣中肯定没有Fe,只有Cu;(2)、若步骤2甲的试管中反应式为Na2SO3+BaCl2=BaSO3↓+2NaCl或、H2SO4+BaCl2=BaSO4↓+2HCl,第3步不能使用其它任何仪器和试剂,只能将乙试管中溶液逐渐倒入甲试管,若沉淀不溶解,但有气泡产生,则甲是Na2SO3溶液,乙是稀H2SO4;若先无气泡,后有气泡产生,则甲是稀H2SO4,乙是Na2SO3溶液;因为BaSO3与稀H2SO4混合立即反应,生成硫酸钡沉淀、SO2和H2O,而稀HCl与少量的Na2SO3反应时无明显现象,生成NaHSO3,与足量的Na2SO3溶液反应时生成SO2。3+的氧化性、Cu的还原性、氧化还原反应的先后、物质推断、物质检验方案的设计、离子方程式的书写等相关知识。
本题难度:一般
5、选择题 下列有关物质用途的说法中,正确的是
A.氨气是生产硝酸的重要原料
B.甲烷与氯气反应可制得纯净的一氯甲烷
C.铁制容器可用来盛放稀硝酸
D.油脂经皂化反应可获得高级脂肪酸
参考答案:A
本题解析:A、氨气经过一系列转化可以生成硝酸,A正确;B、甲烷与氯气的取代反应得到的卤代烃是混合物,得不到纯净的一氯甲烷,B不正确;C、稀硝酸在常温下即可氧化单质铁,不能用铁制容器盛放稀硝酸,但可以盛放浓硝酸或浓硫酸,C不正确;D、油脂在碱性条件下的水解反应是皂化反应,皂化反应得到的是高级脂肪酸钠和甘油,D不正确,答案选A。
本题难度:一般