1、实验题 某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(1)该反应的离子方程式为____________________________。
(2)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
A.反应放热导致温度升高 B.压强增大 C.生成物的催化作用 D.反应物接触面积增大
(3)初步探究。测定反应过程中溶液不同时间的温度,结果如下表

结合实验目的和表中数据,你得出的结论是__________________________________。
(4)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请根据以下实验设计表将实验目的补充完整
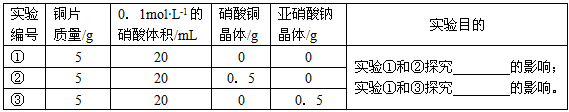
参考答案:(1)3Cu+8H++2NO3-==3Cu2++2NO↑+4H2O
(2)AC
(3)温度不是反应速率明显加快的主要原因
(4)Cu2+;亚硝酸根
本题解析:
本题难度:一般
2、填空题 牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列平衡,向右为脱矿过程,向左为矿化过程:Ca5(PO4)3OH(s) 5Ca2++3
5Ca2++3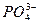 +OH-
+OH-
(1)人进食后,细菌和酶作用于食物产生有机酸,这时牙齿就会受到腐蚀,其原因是____
_______________________________________________________________________________。
(2)Ca5(PO4)3F(s)的溶解度比上面的矿化产物更小,质地更坚固。请用离子方程式表示,当牙膏中配有氟化物添加剂后能够防止龋齿的原因是___________________________________。
(3)根据以上原理,请提出一种其他促进矿化的方法________________________________。
参考答案:(1)Ca5(PO4)3OH(s) 5Ca2++3
5Ca2++3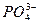 +OH-平衡在酸性条件下向右移动,因为OH-被H+中和:H++OH-====H2O
+OH-平衡在酸性条件下向右移动,因为OH-被H+中和:H++OH-====H2O
(2)牙膏中配有的氟化物电离出F-,与Ca2+、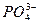 发生如下反应:
发生如下反应:
5Ca2++3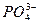 +F-====Ca5(PO4)3F↓
+F-====Ca5(PO4)3F↓
(3)加Ca2+或加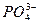
本题解析:根据题意:牙齿表面的一层硬物质存在如下平衡:
Ca5(PO4)3OH 5Ca2++3
5Ca2++3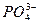 +OH-,进食后产生有机酸,电离出H+与OH-结合生成H2O,破坏上述平衡,使其向脱矿方向移动,牙齿受到腐蚀。当用含氟牙膏刷牙时,5Ca2++3
+OH-,进食后产生有机酸,电离出H+与OH-结合生成H2O,破坏上述平衡,使其向脱矿方向移动,牙齿受到腐蚀。当用含氟牙膏刷牙时,5Ca2++3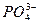 +F-====Ca5(PO4)3F↓,产生了质地更坚硬的固体物质,使牙齿受到保护。从Ca5(PO4)3OH在唾液中的平衡可以看出,加入Ca2+或加入
+F-====Ca5(PO4)3F↓,产生了质地更坚硬的固体物质,使牙齿受到保护。从Ca5(PO4)3OH在唾液中的平衡可以看出,加入Ca2+或加入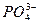 都可促进矿化。
都可促进矿化。
本题难度:简单
3、实验题 (17分)草酸晶体的组成可表示为H2C2O4·xH2O。实验室常用其加热分解制取CO气体,反应方程式为:H2C2O4·xH2O  CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。
CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。

(1)A装置为加热分解草酸的装置,该装置错误是_________________,C装置中盛放的试剂是_______ (填化学式),E装置的作用是__________。
(2)实验过程中涉及到如下操作:
①点燃A处的酒精灯
②熄灭A处的酒精灯
③点燃D处的酒精灯
④熄灭D处的酒精灯。
这4步操作由先到后的顺序为_______(填序号)。点燃D处酒精灯前必须要进行的操作名称是__________。
(3)用酸性高锰酸钾溶液滴定草酸晶体,求x的值。
实验步骤:准确称取1.17g 草酸晶体,配成100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0500mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液16.00mL。滴定时,所发生的反应为:2MnO4-+5H2C2O4+6H+ = 10CO2+2Mn2++8H2O。
①配制草酸溶液除需要玻璃棒、烧杯,还一定需要的玻璃仪器有_____________。
②x=________。
(4)为探究催化剂对化学反应速率的影响,在甲乙试管中分别加入下列物质
试管
| 0.01mol/L KMnO4
| 0.1mol/L H2C2O4
| 0.1mol/L H2SO4
| MnSO4固体
|
甲
| 4 mL
| x mL
| 1 mL
| 无
|
乙
| y mL
| 2mL
| 1 mL
| 有
|
则x=_______,y=________。能够得出催化剂对该反应有影响结论的实验现象是___________________。
参考答案:(1)试管口应向上倾斜(或应向下倾斜),浓硫酸,安全瓶(或防倒吸)
(2)①③④②,验纯
(3)①100mL容量瓶,胶头滴管; ②1.5
(4)2,4,加入MnSO4固体的试管中溶液褪色速率比未加的快。
本题解析:(1)由图可知,加热时,试管口应略向下倾斜;加热生成的产物为CO、CO2及H2O,B中加入吸收CO2的物质,C中加入浓硫酸进行干燥,E为安全瓶,防止液体倒吸;
(2)在实验过程中,应先点燃A处的酒精灯,再点燃D处的酒精灯,反应结束后,方向相反,先熄灭D处的酒精灯,再熄灭A处的酒精灯;实验过程中用到的是CO,为易燃易爆的气体,故需要在使用前验纯;
(3)①实验室配制一定浓度的溶液,需要的仪器有托盘天平、烧杯、玻璃棒、容量瓶、胶头滴管等,其中属于玻璃仪器的是玻璃棒、烧杯、100ml容量瓶、胶头滴管;
②2MnO4-~5H2C2O4
25
0.0008mol0.002mol
n(H2C2O4)=0.002×5=0.01mol
则有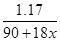 =0.01解得x=1.5
=0.01解得x=1.5
(4)由题意可知,对比催化剂的催化效果,那么在其他条件相同的条件下比较,故x=2,y=4,通过表格得出结论加入MnSO4固体的试管中溶液褪色速率比未加的快。
考点:实验现象的评价,化学反应的基本计算,催化剂的催化效果的比较
本题难度:困难
4、选择题 在恒容条件下,能使NO2(g)+CO(g)
参考答案:
本题解析:
本题难度:一般
5、实验题 (12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
①分别取等体积的2 mol/L
硫酸于试管中;
②分别投入大小、 形状相同 形状相同
的Cu、Fe、Mg。
| 反应快慢:
Mg>Fe>Cu
| 反应物的性质越活泼,反应速率越快。
|
?
该同学的实验目的是研究?? ??对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持
??对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持 ?条件相同。
?条件相同。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。
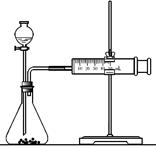
完成该实验应选用的实验药品是?
?;应该测定的实验数据是?。
参考答案:(共12分)
(1)反应物本身的性质;温度;(每空2分)
(2)Mg(或Fe)、0.5mol/L硫酸和2mol/L硫酸;(6分)
测定一定时间产生气体的体积(或者测定一定体积的气体所需时间);(2分)
本题解析:略
本题难度:一般