|
高考化学知识点归纳《影响化学反应速率的因素》高频试题强化练习(2019年最新版)(四)
2019-06-28 21:57:35
【 大 中 小】
|
1、选择题 工业上制硫酸的第二步反应:2SO2(g)+O2(g) 2SO3(g) △H<0,反应达到平衡后,改变某一个条件,下列示意图曲线①~⑧中正确的是 2SO3(g) △H<0,反应达到平衡后,改变某一个条件,下列示意图曲线①~⑧中正确的是

A.①⑥⑧
B.①⑤⑦
C.②③④
D.③⑥⑦
|
参考答案:B
本题解析:由于该反应是气体体积减小且放热的反应,所以当温度升高时,平衡逆向移动,平衡常数减小;使用催化剂对平衡移动没有影响,所以反应物转化率不变;平衡常数只受温度的影响,所以增加氧气的物质的量,平衡常数不变;压强增大,平衡向正反应方向移动,所以三氧化硫的物质的量浓度增大,所以图中①⑤⑦三条曲线是正确的,故选B;
考点:化学平衡专题
本题难度:一般
2、填空题 (12分)
(1)某课外兴趣小组对H2O2的分解速率做了如下实验探究。下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
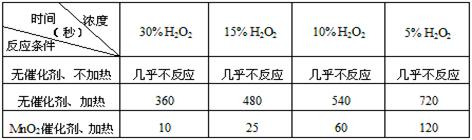
①该研究小组在设计方案时。考虑了浓度、 、 等因素对过氧化氢分解
速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对化学反应速率有何影响?
。
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
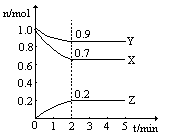
①该反应的化学方程式为 ;
②从开始至2min,Z的平均反应速率为 ;2min后Z的生成速率与2min末Z的生成速率 (“是”或“否”)相等,理由是 。
参考答案:①温度、催化剂
②其他条件不变时,升高温度化学反应速率增大或加催化剂化学反应速率增大等等
(2)① 3X + Y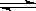 2Z; ② 0.05mol/(L·min) ; 是,2min时,反应达到了平衡,各物质的物质的量浓度不再改变,反应速率也不再改变。 2Z; ② 0.05mol/(L·min) ; 是,2min时,反应达到了平衡,各物质的物质的量浓度不再改变,反应速率也不再改变。
本题解析:(1)考查外界条件对反应速率的影响。根据反应条件可判断,在实验中主要考虑的是浓度、温度、催化剂对反应速率的影响。根据实验现象可知其他条件不变时,升高温度化学反应速率增大,使用催化剂化学反应速率增大。
(2)根据图像可判断,X、Y是反应物,Z是生成物。反应进行到2min时,X、Y、Z的变化量(mol)分别是0.3、0.1、0.2,根据变化量之比是相应的化学计量数之比可知反应的方程式为
3X + Y 2Z。反应速率通常用单位时间内浓度的变化量来表示,所以从开始至2min,Z的平均反应速率为 2Z。反应速率通常用单位时间内浓度的变化量来表示,所以从开始至2min,Z的平均反应速率为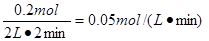 。由图像可判断,反应进行到2min时,各种物质的物质的量均不再随时间变化而变化,所以反应达到化学平衡状态,因此2min后Z的生成速率与2min末Z的生成速率是相等的。 。由图像可判断,反应进行到2min时,各种物质的物质的量均不再随时间变化而变化,所以反应达到化学平衡状态,因此2min后Z的生成速率与2min末Z的生成速率是相等的。
本题难度:困难
3、选择题 某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)?2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示.下列说法中正确的是( )

A.30min时降低温度,40min时升高温度
B.反应方程式中的x=1,正反应为吸热反应
C.8min前A的平均反应速率为0.08mol/(L?min)
D.30min~40min间该反应使用了催化剂
参考答案:A.由图象可知,30min时正、逆反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故A错误;
B.由开始到达到平衡,A、B的浓度减少的量相同,由此可知X=1,则增大压强平衡不移动,40min时,正逆反应速率都增大,且逆反应速率大于正反应速率,平衡向逆向进行,应是升高温度,则正反应为放热反应,故B错误;
C.反应从开始到8min内A浓度减少了0.64mol/L,故A的反应速率为0.64mol/L8min=0.08 mol/(L?min),故C正确;
D.由A中分析可知,30min时正、逆反应速率降低了,反应物与生成物的浓度瞬时降低,反应仍处于平衡状态,故不能是温度变化,而是降低了压强,故D错误;
故选:B.
本题解析:
本题难度:简单
4、选择题 下列事实中,不能用勒夏特列原理解释的是
A.溴水中有下列平衡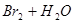  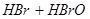 ,当加入 ,当加入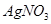 溶液后,溶液颜色变浅 溶液后,溶液颜色变浅
B.对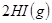  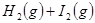 平衡体系,增大平衡体系的压强可使颜色变深 平衡体系,增大平衡体系的压强可使颜色变深
C.反应  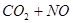 (正反应放热),升高温度可使平衡向逆反应方向移动 (正反应放热),升高温度可使平衡向逆反应方向移动
D.打开啤酒瓶盖后产生大量的气泡
参考答案:B
本题解析:如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行,这就是勒夏特列原理,该原理适用于所有的平衡体系。选项B中反应前后体积不变,改变压强平衡不移动,颜色加深是因为碘单质的浓度增大了,其余都是可以的,答案选C。
本题难度:简单
5、选择题 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A.加热
B.加入硝酸钠固体
C.滴加少量CuSO4溶液
D.不用铁片,改用铁屑
参考答案:B
本题解析:考查外界条件对反应速率的影响。温度越高,浓度越大反应速率越快。反应物的接触面积越大,反应速率越快。滴加少量硫酸铜溶液,铁可以置换出铜,构成原电池加快反应速率。若加入硝酸钠,则在酸性溶液中铁和硝酸反应生成物不是氢气而是NO,所以答案是B。
本题难度:一般
|