1、实验题 某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验。
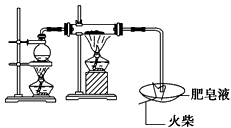
(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当________时(填实验现象),说明“铁与水蒸气”能够进行反应。写出铁与水蒸气反应的化学方程式 ____________________________
(2)为了研究一定时间内铁粉的转化率,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成气体的体积,计算出铁粉的转化率。
①收集并测量气体体积应选图中的________装置。
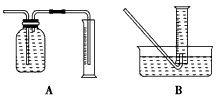
②称取0.28 g铁粉与适量石棉绒混合,然后加热至无气体放出。若室温下氢气密度约为0.088 g/L,最好选用________规格的量筒(选填字母序号)。
A.100 ml B.200 mL C.500 mL D.1000 mL
③收集的气体体积为V L,则铁粉的转化率为________。
参考答案:(1)肥皂泡破裂,有爆鸣声;3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(2)①B;②B;③6.6 V×100%
本题解析:
本题难度:一般
2、选择题 如图,木炭与浓硫酸共热产生的气体x和铜跟浓硝酸反应产生的气体y同时通入盛有过量M的洗气瓶中,下列说法正确的是 (?)
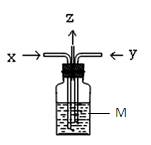 ?(?
?(?
A.若M为BaCl2溶液,则洗气瓶中会产生BaCO3和BaSO3沉淀
B.若M为Ba(OH)2溶液,洗气瓶中只会产生BaCO3沉淀
C.若M为KI淀粉溶液,洗气瓶中溶液一定会出现蓝色
D.若M为水,在z导管口有红棕色气体出现
参考答案:D
本题解析:略
本题难度:一般
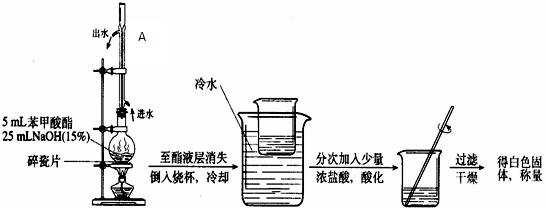
3、实验题 某化学小组以苯甲酸为原料制取苯甲酸甲酯,并用制得的苯甲酸甲酯进行碱性水解的实验。
I.制取苯甲酸甲酯:已知有关物质的沸点如下表:
物质
| 甲醇
| 苯甲酸
| 苯甲酸甲酯
|
沸点/℃
| 64.7
| 249
| 199.6
|
实验装置如下:

(1)简述第一步混合液体时,最后加入浓硫酸的理由是
?。
若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:
?。
(2)分液时上层液体从?出来;接受馏分时温度控制在?。
(3)此制取过程比教材中乙酸乙酯的制备复杂很多,写出用此过程制备苯甲酸甲酯的两大优点:?、?。
II、苯甲酸甲酯碱性水解
(4)写出苯甲酸甲酯碱性水解的化学反应方程式?。
(5)写出苯甲酸甲酯碱性水解实验装置中A的作用?。
III、苯甲酸甲酯有多种同分异构体
(6)符合下列条件的结构
①可以发生银镜反应②属于芳香族化合物③不具备其它环状结构④不能与FeCl3发生显色反应;共有?种。
参考答案:(16分)(1)浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,甲醇易挥发;(2分)? C6H5CO18OH+CH3OH C6H5COOCH3+H218O 。(2分)
C6H5COOCH3+H218O 。(2分)
(2)分液漏斗的上口;199.6℃左右。(各2分)(3)产率高;纯度高。(2分)
(4)C6H5COOCH3 + NaOH? →?C6H5COONa + CH3OH。(2分)
(5)冷凝回流。(2分) (6)12? (2分)
本题解析:I(1)浓硫酸密度较大,且与苯甲酸、甲醇混合放出大量热量,为确保实验的安全所以采用最后加入浓硫酸,再加上甲醇的沸点低易挥发;
酯化反应的特点是:酸脱羟基醇脱氢,所以其反应机理为:
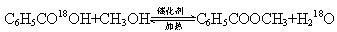
(2)分液时,上层液体应从分流漏斗的上口倒出,下层液体应从分流漏斗的下口倒出。
根据苯甲酸甲酯的沸点可知,接受馏分时温度控制在199.6℃左右
(3)这样操作可以使反应物尽可能多的转化为生成物,使反应物得到充分反应,且生成的产物更纯。
II:(4)酯的水解反应是酯化反应的逆反应,且酯在碱性条件下水解较彻底
C6H5COOCH3 + NaOH? →?C6H5COONa + CH3OH
(5)该装置中冷管的作用为冷凝回流
III(6)共12种,如下图所示
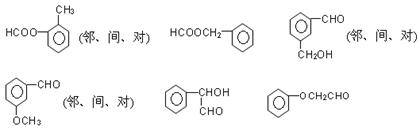
能发生银镜反应的物质有:醛类、甲酸、甲酸某酯、甲酸盐、还原性糖等。
本题难度:简单
4、选择题 下列实验装置是探究铜丝与过量浓硫酸的反应,下列叙述正确的是 (?)

A.上下移动①中铜丝可控制SO2的量
B.②中品红溶液不褪色
C.③中石蕊溶液变蓝色
D.为确认CuSO4生成,向①中加水,观察溶液颜色
参考答案:A
本题解析:在加热的条件下,当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触,反应停止,故可通过上下移动①中铜丝可控制SO2的量,故A正确;SO2具有漂白性,品红能被二氧化硫漂白,可用品红溶液验证SO2的生成,故B不正确;SO2为酸性气体,溶于水显酸性,能使石蕊溶液变红色,故C不正确;铜与浓硫酸的反应Cu+2H2SO4 ?CuSO4+SO2↑+2H2O,实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中含有大量水,不会生成白色固体,CuSO4溶液呈蓝色,为确认CuS04生成,无须向①中加水,故D错误,答案选A。
?CuSO4+SO2↑+2H2O,实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中含有大量水,不会生成白色固体,CuSO4溶液呈蓝色,为确认CuS04生成,无须向①中加水,故D错误,答案选A。
点评:该题是中等难度的试题,试题基础性强,紧扣教材,意在巩固学生的基础,提高学生的实验分析和探究能力,有利于培养学生的学习兴趣,激发学生的学习积极性。答题时注意二氧化硫的酸性和漂白性。
本题难度:简单
5、实验题 无水CuSO4在一定条件下发生如下反应:
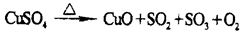
有人设计通过实验测定反应生成的SO3、SO2和O2,并经过计算确定该条件下分解反应方程式各物质的化学计量数,实验所需仪器装置如图所示。
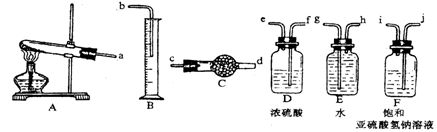
实验测得数据及有关结果如下:
①准确称量无水CuSO4?6.0g。
②测出量筒中水的体积后,折算成排水的气体在标准状况下的体积为280ml。
③干燥管中的质量在实验结束时增加了3.2g。
④实验结束时,装置F中的溶液变成Na2SO4溶液(不含其他杂质)。
请回答如下问题:
已知气体从左向右的流向,上述仪器装置接口的连接顺序是a →ji→f e →c d →h g→ b ?
(1)装置F的作用是_________?____,装置D的作用是_______?________。
(2)首先应计算的物质是______________。
通过计算推断,该条件下反应的化学方程式是_______________?______。
(3);(填序号)____________。
参考答案:(10分)(1)吸收SO3,放出等物质的量的SO2(2分)干燥SO2和O2(2分)
O2(2分)? 3CuSO4? ?3CuO+2SO2↑+SO3↑+O2↑(2分)(3)B E(2分)
?3CuO+2SO2↑+SO3↑+O2↑(2分)(3)B E(2分)
本题解析:已知气体从左向右的流向,上述仪器装置接口的连接顺序是a →ji→f e →c d →h g→ b ?
装置F的作用是吸收SO3,放出等物质的量的SO2,装置D的作用是干燥SO2和O2,首先应计算的物质是O2;通过计算推断,测出量筒中水的体积后,折算成排水的气体在标准状况下的体积为280ml是氧气的体积;干燥管中的质量在实验结束时增加了3.2g是二氧化硫的质量;实验该条件下反应的化学方程式是3CuSO4? ?3CuO+2SO2↑+SO3↑+O2↑;该实验设计中,可能给测定带来误差最大的装置是B 量筒测量的不精确。E排水的瓶子中一定还会剩余有残余气体。所以二者对实验带来的误差最大。
?3CuO+2SO2↑+SO3↑+O2↑;该实验设计中,可能给测定带来误差最大的装置是B 量筒测量的不精确。E排水的瓶子中一定还会剩余有残余气体。所以二者对实验带来的误差最大。
点评:此类题目一定要时刻把握实验的目的,每一步的设计都是为了实验目的的达成。弄清楚化学实验的原理是解题的关键。
本题难度:一般