1、实验题 (8分)大理石中含有的主要杂质是氧化铁,以下是某化学兴趣小组用大理石为原料制取安全无毒杀菌剂过氧化钙的主要流程:
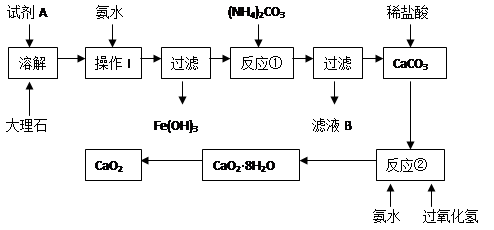
请回答下列问题:
(1)试剂A的名称是?;
(2)操作I的目的是?;
(3)本实验需要多次使用玻璃棒,则本实验过程中玻璃棒的作用有?;
(4)写出反应②中生成CaO2·8H2O的化学方程式:?;
参考答案:(1)硝酸或盐酸(2分)?
(2)调节溶液的pH,使Fe3+完全沉淀(2分)
(3)搅拌和引流(2分)
(4)CaC12 + H2O2 + 2NH3 + 8H2O ═ CaO2·8H2O↓ + 2NH4Cl (2分)
本题解析:为除去大理石中的杂质,先用盐酸或硝酸将样品溶解(碳酸钙与硫酸反应生成的硫酸钙微溶于水,易形成一层薄膜阻止反应的进行),加氨水调节PH命名Fe3+完全沉淀;过滤后向滤液中加入碳酸铵,过滤出碳酸钙沉淀。再将碳酸钙有盐酸溶解后加氨水和过氧化氢,制取产品。
本题难度:一般
2、选择题 1 mL密度为0.93 g·cm―3的氨水恰好中和0.005mol H2SO4生成(NH4)2SO4,若要配制上述浓度的氨水,在1L水中需要溶解标准状况下的氨气(?)
A.294.7 L
B.378.0 L
C.2240.0 L
D.1120.0 L
参考答案:A
本题解析:略
本题难度:简单
3、填空题 (6分)根据正放在桌面上的右图装置,回答下列问题:

(1)现有H2、SO2、NH3、N2?四种气体
①用排空气法收集某气体,则由A口进气可收集到的气体为?。
②用排水法收集某气体,可在该容器中充满水,气体应由?口进入。
(2)若用该装置除去H2中的水分,容器中可盛放的试剂为?。
参考答案:(6分)(1)? ① SO2? ② B?(2)浓硫酸
本题解析:(1)①由A口进气,说明收集的气体密度大于空气的,因此是SO2。
②用排水法收集某气体,可在该容器中充满水,则气体应由B口进入,水从A排出。
(2)干燥氢气可以选择浓硫酸。
点评:常见气体的收集方法是:1.排水法,适用于不易溶于水的气体。例如氢气,氧气;2.向上排空气法,适用于比空气密度大,溶于水的气体,例如二氧化碳,氯气;3,向下排空气法,适用于比空气密度小,溶于水的气体,例如氨气。
本题难度:一般
4、选择题 下列实验操作中,正确的是?(?)
A.配制5%NaCl溶液时,将称量的NaCl放入烧杯中加计量的水搅拌溶解
B.配制1mol·L-1NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶
C.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
D.分液操作时,先将分液漏斗中的下层液体放出,然后再将上层液体放出
参考答案:A
本题解析:考查实验基本操作
A.正确
BC项:烧碱溶液或浓硫酸不能直接注入容量瓶,需要先在烧杯中溶解或稀释、冷凝后再移到容量瓶中
D项:分液操作时,先将分液漏斗中的下层液体从下口放出,然后再将上层液体自上口倒出
故答案为A
本题难度:一般
5、实验题 (8分)
用实 验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。其具体实验步骤如下:
验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。其具体实验步骤如下:
①取一支碱式滴定管(如图有两只滴定管,你选择哪一只?)?(填写对应字母),用少量标准NaOH溶液润洗2~3次水洗后的碱式滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;

②用酸式滴定管精确地放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中。再加入酚酞试液2滴;
③滴定时,边滴边振荡,同时眼睛注视锥 形瓶内溶液颜色的变化,当锥形瓶内溶液由
形瓶内溶液颜色的变化,当锥形瓶内溶液由
?(填写颜色变化)且半分钟内不褪色时,即达到滴定终点;
④记录液面刻度读数。根据滴定管的两次读数得出消耗标准盐酸的体积,再重复测定两次,实验结果记录见下表:
实验次数
| 起始滴定管读数
| 终点滴定管读数
|
1
| 0.00mL
| 24.02mL
|
2
| 0.50mL
| 24.46mL
|
3
| 1.00mL
| 25.02mL
|
测得未知稀盐酸的物质的量浓度为?(保留小数点后3位)。
⑤如果滴定结束时俯视碱式滴定管刻度读数(其它操作均正确),则对滴定结果稀盐酸浓度的影响是?(填“偏高”、“偏低”或“无影响”)。
参考答案:① b?③无色→浅红色?④ 0.096mol/L?⑤偏低
本题解析:略
本题难度:一般