|
高中化学知识点讲解《气体的净化、干燥、吸收与收集》高频试题巩固(2019年最新版)(四)
2019-06-28 22:21:41
【 大 中 小】
|
1、实验题 从固体物质A开始,可以发生如下框图所示的一系列变化:

完成下面问题:
(1)在实验室中收集气体B的方法是?。
(2)操作①的名称是?。
在操作①中所使用的玻璃仪器的名称是?。
(3)写出反应②和反应③的化学方程式:
反应②?
反应③?。
(4)A的化学式是?。
(5)在实验室中,如要获得干燥纯净的气体D,可以将它通过如上右图所示的装置,其中瓶I中盛放的试剂是?,瓶Ⅱ中盛放的试剂是?。
收集干燥气体D的方法是?。
参考答案:(1)排水集气法
(2)过滤;漏斗、玻璃棒、烧杯
(3)Ca(OH)2+CO2=CaCO3↓+H2O;Ca(OH)2+Ca(HCO3)2=2CaCO3↓+2H2O
(4)CaC2
(5)饱和碳酸氢钠溶液,浓硫酸。向上排空气法
本题解析:略
本题难度:简单
2、选择题 在实验室里可按如图所示的装置来干燥和收集气体R,多余的气体用水进行吸收,则R是( )
A.Cl2
B.NO
C.CH4
D.NH3
| 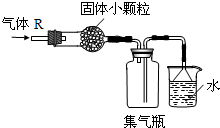
参考答案:该装置的收集装置是利用向下排空气法收集,则收集的气体密度小于空气密度,且和氧气不反应,尾气处理装置中用水吸收气体,说明该气体极易溶于水,
A.氯气密度大于空气,应采用向上排空气法收集,故A错误;
B.一氧化氮和氧气能反应生成二氧化氮,所以不能用排空气法收集,故B错误;
C.甲烷的密度小于空气,且和氧气、水不反应,所以尾气不能用水吸收,故C错误;
D.氨气的密度小于空气,常温下和氧气不反应,且具有溶于水,所以可以用水吸收尾气,故D正确;
故选D.
本题解析:
本题难度:一般
3、实验题 阅读下面三段材料:
①早在1785年,卡文迪许在测定空气组成时,除去空气中的O2、N2等已知气体后,发现最后总是留下一个体积不足总体积1/200 的小气泡。
②1892年,瑞利在测定氮气密度时,从空气中得到的氮气密度为1.2572g/L, 而从含氮化合物分解得到的氮气密度为1.2508g/L。两者相差0.0064g/L。
③瑞利和拉姆赛共同研究后认为:以上两个实验中的 “小误差”可能有某种必然的联系,并预测大气中含有某种较重的未知气体。经反复实验,他们终于发现了化学性质极不活泼的惰性气体——氩。
请回答下列问题:
(1)材料①、②中的“小误差”对测定空气组成和氮气密度的实验而言是主要因素还是次要因素?
(2)材料③中科学家抓住了“小误差”而获得重大发现说明了什么问题?
参考答案:(1)次要因素;(2)科学研究应有严谨的科学态度。
本题解析:(1) “小误差”对测定空气的主要成分而言是次要因素,对氮气的密度影响很小,也是次要因素。但对空气所有成分的测定来说是绝不能忽略的主要因素之一。(2)只要有误差,就会有误差产生的原因,找出产生误差的原因,可能会有重大的发现。科学一定要严谨。
本题难度:简单
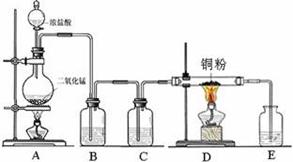
4、实验题 实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
已知烧瓶内发生的是制取氯气的反应:MnO2+4HCl(浓) 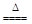 MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O
(1)(2分)用双线桥法标出烧瓶内发生反应的电子转移方向和数目
MnO2+4HCl(浓) 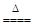 MnCl2+Cl2↑+2H2O。 MnCl2+Cl2↑+2H2O。
(2)B处盛有饱和食盐水,其作用是?。
(3)C处盛放的是下列试剂中的_______(填序号);E处盛放的是下列试剂中的______(填序号),发生反应的离子方程式为 ?。
a、水? b、氢氧化钠溶液? c、浓硫酸? d、饱和食盐水
(4)有同学认为该装置存在缺陷,改进的方法是__________________________________。
参考答案:(1)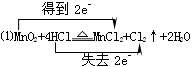
(2)吸收氯气中的氯化氢气体?
(3)c? b(填序号) 2OH—+Cl2==Cl—+ClO—+H2O
(4)在D与E 之间增加一支装有碱石灰的干燥管
本题解析:先明确实验目的:制取纯净的无水CuCl2,
思路分析:先要制备纯净、干燥的Cl2,再Cl2与Cu反应,
分析装置图:A为制备氯气的反应装置,B处盛有饱和食盐水,其作用是吸收氯气中的氯化氢气体,C中盛有浓硫酸,其作用是除氯气中的水蒸气,D中Cl2与Cu反应生成CuCl2,E中盛有氢氧化钠溶液,其作用是吸收多余的氯气;
(4)该装置存在缺陷是,因E中盛有氢氧化钠溶液,故可给D代入水蒸气,故应在在D与E 之间增加一支装有碱石灰的干燥管,从而避免这个缺陷;
本题难度:简单
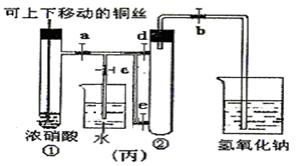
5、实验题 (8分)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生改进后的装置:

(1)写出铜和浓硝酸反应的化学方程式??。
(2)和甲装置相比,乙装置的优点??。
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置。先关闭弹簧夹??,再打开弹簧夹??,才能使NO2气体充满②试管。
(4)当气体充满②试管后,欲使烧杯中的水进入②试管应如何操作??。
参考答案:(1)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O?(2分)
(2)①可以控制反应。②吸收NO2气体,防止污染环境。(2分)
(3)关闭c,d;打开a、b,e。(2分)
(4)先关闭b,迅速将铜丝提起与溶液脱离,再关闭a,e, 然后打开c,d,用手捂住②试管(热水、热毛巾、加热)。(合理答案均给分)?(2分)
本题解析:(1)硝酸具有强氧化性,能把铜氧化生成硝酸铜、NO2和水,方程式为
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O。
(2)乙中铜丝可以上下移动,因此便于控制反应;其次有尾气处理装置,吸收NO2气体,防止污染环境。
(3)NO2的密度大于空气的,所以应该是先关闭弹簧夹c、d,然后再打开弹簧夹a、b、e,才能时NO2气体充满试管②。
(4)欲使烧杯中的水进入②试管,则必须使NO2溶于水降低越强,所以正确的操作是先关闭b,迅速将铜丝提起与溶液脱离,再关闭a,e,然后打开c,d,用手捂住②试管(热水、热毛巾、加热)。
本题难度:一般
| 