1、填空题 如图所示的甲、乙、丙三种晶体试写出
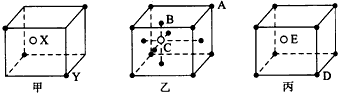
(1)甲晶体的化学式(X为阳离子)为____________。
(2)乙晶体中A、B、C三种粒子的个数比是________。
(3)丙晶体中每个D周围结合E的个数是________个。
参考答案:(1)X2Y
(2)1:3:1
(3)8
本题解析:
本题难度:一般
2、填空题 (10分)有A、B、C、D、E、F六种元素,已知:它们位于三个不同短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数比1﹕1或2﹕l形成化合物;B、C分别都能与D按原子个数比1﹕1或1﹕2形成化合物。
⑴写出只含有A、B、D、E四种元素的两种常见无水盐的化学式_____________。
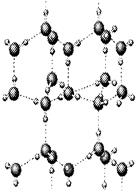
⑵下图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示__________。E与D按原子个数比1﹕1形成的化合物的电子式为_____________________。
⑶人们通常把拆开l mol某化学键所吸收的能量看成该
化学键的键能。键能的大小可以衡量化学键的强弱,也可以
 用于估算化学反应的反应热(△H),化学反应的△H等于反应
用于估算化学反应的反应热(△H),化学反应的△H等于反应
中断裂旧化学键的键能之和与反应中形成新化学键的键能之和
的差。下表列出了上述部分元素形成的化学键的键能:
化学键
| F—D
| F—F
| B—B
| F—B
| C═D
| D═D
|
键能/kJ·mol-1
| 460
| 176
| 347.7
| 347
| 745
| 497.3
|
①下列三种物质形成的晶体,熔点由高到低的顺序(用a、b、c表示):_________。
a.F与B形成的化合物? b.B与D形成的稳定化合物? c.F的单质
②试估算F单质晶体的燃烧热:____________________________________。
参考答案:(1)NaHCO3、CH3COONa? (2)氢键?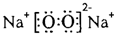
(3) ① a>c>b?②990.7 kJ/mol
本题解析:考查元素周期表的结构、晶体的判断及有关反应热的计算。
根据所给元素的性质可判断,A是H,B是C,C是N,D是O,E是Na,F是Si。
(1)只含有H、C、O、Na四种元素的两种常见无水盐分别为碳酸钠和醋酸钠。
(2)H和O形成的常见化合物是水,水中存在氢键,所以虚线表示氢键。Na和O按原子个数比1﹕1形成的化合物是过氧化钠,含有离子键和非极性键。
(3)①a是SiC属于原子晶体,b是CO2,是分子晶体,c是Si,也是原子晶体。因为Si-C的键能大于Si-Si的键能,所以碳化硅的熔点高于硅的,硅的高于CO2的,即a>c>b。
②硅和氧气反应的化学方程式为Si+O2=SiO2,因为1个硅原子形成2个Si-Si,在二氧化硅晶体中1个硅原子形成4个Si-O,所以该反应的燃烧热是2×176 kJ·mol-1+497.3 kJ·mol-1-4×460 kJ·mol-1=990.7 kJ/mol。
本题难度:一般
3、选择题 上个世纪80年代,科学家通过研制发现了一种新型分子,这种新型分子具有空心的类似足球状的结构,其化学式是C60。有关C60的下列说法中正确的是?
A.C60中可能含有离子键
B.C60中的化学键只有共价键
C.C60是一种新型的化合物
D.C60和金刚石互为同位素
参考答案:B
本题解析:A错,C60中只含有非极性共价键;B正确;C错,C60是一种新型的单质;D错,C60和金刚石互为同分异构体;
本题难度:一般
4、推断题 X、Y、Z、W、R为前四周期原子序数依次增大的五种元素,X、Y、Z、W为同一周期相邻元素,Z元素原子核外电子的运动状态共有8种;R元素与比它核电荷数大的另外两种元素位于第四周期同一族。
(1)X的一种核素用于鉴定文物年代,该核素的符号为____。
(2)X、Y、Z、W四种元素第一电离能由大到小的顺序为____(用元素符号表示)。
(3)用氢键表示式写出W的气态氢化物水溶液中不同种分子间存在的氢键____。
(4)Y的一种氢化物分子中共有18个电子,该分子中存在的共价键类型有____(填选项字母)。
A.非极性键;B.极性键;C. ?键;D.
?键;D. 键;E.p—p
键;E.p—p 键;F.
键;F.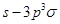 键;G.
键;G.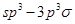 键;H.
键;H.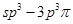 键
键
(5)R的基态原子的价层电子排布式为____,R元素位于周期表的____区。
(6)R单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如下图所示:
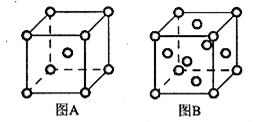
图A中原子堆积方式为??,A、B中R原子的配位数之比为____。A、B晶胞的棱长分别为a cm和b cm,则A、B两种晶体的密度之比为____。
参考答案:
(1)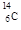 或
或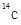 ?(2)F、N、O、C?(3)F-H…O、O-H…F?(4)ABFG
?(2)F、N、O、C?(3)F-H…O、O-H…F?(4)ABFG
(5)3d64s2;d?(6)体心立方;2∶3;b3∶2a3
本题解析:
试题解析:Z元素原子核外电子的运动状态共有8种,则Z原子核外共有8个电子,Z为8号元素O,X、Y、Z、W位于同一周期且相邻,则X为C,Y为N,W为F。第四周期同一族有三种元素的只有第VIII族,R的原子序数最小,则R为Fe。
(1)用于鉴定文物年代的C的同位素是14C。
(2)同一周期元素第一电离能自左向右有增大的趋势,但因第VA族元素的p轨道处于半满状态,较稳定,因此第一电离能大于同周期第VIA族元素,故四种元素的第一电离能由大到小的顺序为F>N>O>C。
(3)HF的水溶液中不同分子间存在的氢键有F-H…O、O-H…F。
(4)18电子的氮的氢化物为N2H4。分子中的氮氮键为非极性键,属于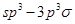 键,氮氢键为极性键,属于
键,氮氢键为极性键,属于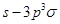 键。
键。
(5)基态Fe的价层电子排布为3d64s2,Fe位于周期表的d区。
(6)A晶胞的堆积方式是体心立方,原子的配位数是8,B晶胞的堆积方式是面心立方,原子的配位数是12,因此A、B中Fe原子的配位数之比为8:12=2:3。A晶胞中含有Fe原子数位2个,晶胞的密度是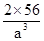 ,B晶胞中含有的Fe原子数为4个,因此晶胞密度为
,B晶胞中含有的Fe原子数为4个,因此晶胞密度为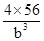 ,二者的密度比为
,二者的密度比为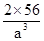 :
: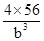 ?= b3∶2a3。
?= b3∶2a3。
本题难度:一般
5、选择题 根据下列性质判断,属于原子晶体的物质是
A.熔点2 700 ℃,导电性好,延展性强
B.无色晶体,熔点3 500 ℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点800 ℃,熔化时能导电
D.熔点-56.6 ℃,微溶于水,硬度小,固态或液态时不导电
参考答案:B
本题解析:离子间通过离子键形成的晶体是离子晶体,分子间通过分子间作用力形成的晶体是分子晶体,原子间通过共价键形成的空间网状结构的晶体是原子晶体,由金属阳离子和自由电子构成的晶体是金属晶体。由于范德华力和氢键,作用力小,所以分子晶体的熔沸点比较低,硬度小。原子晶体的熔沸点高,不导电,一般不溶于其它溶剂,离子晶体的熔沸点也较高,水溶液或在熔融状态下可以导电,金属晶体的一般具有良好的导电和导热性,具有延展性,据此可以判断。A、原子晶体的熔点高,但不能导电,因此熔点2 700 ℃,导电性好,延展性强应该是金属晶体,A不正确;B、无色晶体,熔点3 500 ℃,不导电,质硬,难溶于水和有机溶剂,符合原子晶体的性质特点,B正确;C、无色晶体,能溶于水,质硬而脆,熔点800 ℃,熔化时能导电,符合离子晶体的性质,属于离子晶体,C不正确;D、熔点-56.6 ℃,微溶于水,硬度小,固态或液态时不导电,符合分子晶体的性质,属于分子晶体,D不正确,答案选B。
本题难度:一般