1、填空题 (12分)根据要求完成下列问题:
(1)分析下列物质的物理性质,判断其晶体类型:
A、固态时能导电,能溶于盐酸;B、能溶于CS2,不溶于水;C、固态、液态时均不导电,熔点3500℃
A、??B、??C、?
(2)指出配合物K3[Co(CN)6]中的中心离子、配体及其配位数:_________、__________、_________。
(3)在H2、SiC、CO2、HF中,由极性键组成的非极性分子是?,由非极性键形成的非极性分子是?,能形成分子晶体的化合物是?,含有氢键的晶体的化学式?,属于原子晶体的是?,四种物质熔点由高到低的顺序是?。
参考答案:(1)A、金属晶体? B、分子晶体? C、原子晶体
(2)Co3+? CN-? 6?(3)CO2, H2, CO2?HF , HF ,? SiC , SiC? HF? CO2? H2
本题解析:本题考查物质结构及性质。(1)固态能导电只有金属晶体,因为其中含有自由移动的电子,离子晶体在溶液和熔融状态下可以导电,C熔点高,故为原子晶体,根据相似相溶原理B为非极性分子,为分子晶体。(2)配位化合物中,一般过渡金属为中心原子,CN-为配体,配位数为6。(3)共用电子对的为同一元素的为非极性键,不同元素的为极性键,而分子的极性要看分子对称情况等,H2为非极性键组成的非极性分子,SiC为极性键组成的原子晶体,CO2为极性键组成分非极性分子(直线型),HF为极性键组成的非极性分子,熔沸点高低:原子晶体>离子晶体>分子晶体,分子晶体:①氢键的存在,②分子间作用力(结构相似,相对分子质量越大,作用力越大,熔沸点越高)故有SiC>HF>CO2>H2
本题难度:一般
2、选择题 下列化学式既能表示物质的组成,又能表示物质的一个分子的是?(?)
A.NaOH
B.SiO2
C.Fe
D.C2H4
参考答案:D
本题解析:能表示物质的一个分子的只有分子晶体,D正确。A是离子晶体,B是原子晶体,C是金属晶体,答案选D。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题基础性强,侧重对学生基础知识对巩固和训练。该题的关键是理解只有在分子晶体中才能存在分子,而其余的晶体中不存在分子,据此灵活运用即可得出正确的结论。
本题难度:简单
3、简答题 已知:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上电子相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素.试回答下列有关的问题:
(1)写出F元素的电子排布式______.
(2)己知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为______.
(3)己知C、E两种元素合成的化合物通常有CE3、CE5两种.这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是______.
(4)B、C、D、E的第一电离能由大到小的顺序是______(写元素符号).四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______(写化学式).
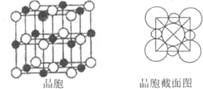
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”.如图所示为B、E形成化合物的晶胞结图以及晶胞的剖面图,晶胞中距离一个Na+最近的Na+有______个.若晶体密度为ρg?cm-3,阿伏加德罗常的值用NA表示,则Cl-的离子半径______cm(用含NA与ρ式子表达).
参考答案:A、B、C、D、E、F六种元素,原子序数依次增大.A原子核外有两种形状的电子云,两种形状的电子云轨道上电子相等,则其原子核外电子排布为1s22s22p4,则A为氧元素;B是短周期中原子半径最大的元素,则B为Na元素;C元素3p能级半充满,则其原子核外电子排布为1s22s22p63s23p3,则C为磷元素;F是第四周期未成对电子最多的元素,则F的核外电子排布为1s22s22p63s23p63d54s1,则F为Cr元素;E是所在周期电负性最大的元素,原子序数大于P小于Cu,则应处于第三周期,故E为Cl元素;D原子序数介于磷、氯之间,则D为硫元素,
(1)F为Cr元素,其原子核外电子排布式为1s22s22p63s23p63d54s1,
故答案为:1s22s22p63s23p63d54s1;
(2)己知A元素的一种氢化物分子中含四个原子,该氢化物为H2O2,H2O2分子中O原子成1个O-O键、1个O-H键,含有2对孤电子对,杂化轨道数目为4,采取sp3杂化,
故答案为:sp3;
(3)P、Cl两种元素合成的化合物通常有PCl3、PCl5两种,PCl3中P原子成3个P-Cl键、含有1对孤电子对,P原子采取sp3杂化,为三角锥型结构,不是对称结构,属于极性分子,
故答案为:三角锥型;
(4)同周期自左而右第一电离能呈增大趋势,P元素3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能P>Cl>S>Na,氢氧化钠为强碱,磷酸属于弱酸,高氯酸、硫酸属于强酸,二者浓度相等,硫酸中氢离子浓度大,硫酸酸性最强,故四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是NaOH>H3PO4>HClO4>H2SO4,
故答案为:P>Cl>S>Na;NaOH>H3PO4>HClO4>H2SO4;
(5)由Na、Cl两元素形成的化合物为NaCl,以中间的黑色球为Na+离子研究,与之最近的Na+离子处于晶胞的棱上,共有12个.晶胞中Na+离子数目=1+12×14=4,Cl-离子数目=8×18+6×12=4,故晶胞质量=4×58.5NAg,晶胞体积=4×58.5NAgρg/cm3=234ρNAcm3,令Cl-离子半径为r,则棱长为
本题解析:
本题难度:简单
4、简答题 请回答下列问题:
(1)羰基铁[Fe(CO)5]会使合成甲醇和合成氨等生产过程中的催化剂中毒.Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂.据此可以判断Fe(CO)5晶体类型为______.
(2)科学家通过X射线探明,MgO、CaO的晶体结构与NaCl晶体结构相似(如图所示)
①比较晶体熔点的高低MgO______CaO(填“高于”或“低于”),
②Mg2+的配位原子所构成的立体几何构型为______,③MgCO3晶格能大于CaCO3,为何MgCO3更易分解______.
(3)Ni的堆积与MgO中氧原子堆积相同,Ni可以吸附H2,氢以单个原子形式填入四面体空隙,则Ni最大量吸收H2后,n(Ni):n(H)=______.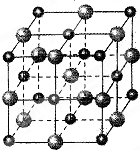
参考答案:(1)由晶体具有常温下为液体,熔沸点低的性质可知,该晶体为分子晶体,故答案为:分子晶体;
(2)①离子晶体中,因镁离子半径小,则晶格能大,所以氧化镁的熔点高于氧化钙的熔点,故答案为:高于;
②以体系为镁离子,六个面的面心为配位原子,则形成空间正八面体结构,故答案为:正八面体;
③碳酸盐分解生成金属氧化物,因镁离子的半径比钙离子的半径小,则氧化镁的晶格能比氧化钙的晶格能大,所以MgCO3更易分解,
故答案为:氧化镁的晶格能比氧化钙的晶格能大;
(3)Ni的堆积与MgO中氧原子堆积相同,O原子占据体心和棱心,晶胞中Ni为1+12×14=4,Ni可以吸附H2,氢以单个原子形式填入四面体空隙,由图可知有个个四面体,则一个晶胞中有8个H,所以Ni最大量吸收H2后,n(Ni):n(H)=4:8=1:2,故答案为:1:2.
本题解析:
本题难度:一般
5、填空题 图3-21是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构。实验测得金属钨的密度为19.30 g·cm-3,钨的相对原子质量是183.9。假设金属钨原子为等径刚性球,试完成下列问题:
(1)每一个晶胞中分摊到__________个钨原子。
(2)计算晶胞的边长a。
(3)计算钨的原子半径r(提示:只有体对角线上的各个球才是彼此接触的)。

图3-21
参考答案:(1)2 (2)3.16×10-8 cm(3)1.37×10-8 cm
本题解析:(1)正确应用分摊法确定一个晶胞中包含的各粒子的数目。
(2)应用基本关系式: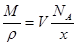 ,先求出晶胞的体积,然后根据V=a3计算晶胞边长。
,先求出晶胞的体积,然后根据V=a3计算晶胞边长。
本题难度:简单