1、填空题 (6分)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知
N2(g)+2O2(g)=2NO2(g)
参考答案:
本题解析:
本题难度:一般
2、简答题 甲醇是一种燃料,也可以作为燃料电池的原料.

(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6KJ/mol
②2CO?(g)+O2(g)=2CO2(g)△H2=-566.0KJ/mol
③H2O(g)=H2O(l)△H3=-44.0KJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______;
(2)甲醇直接燃烧会产生一定的污染,某实验小组依据甲醇燃烧的反应原理,设计如图1所示的电池装置,则电池正极的电极反应式:______,该电池工作时,溶液中的OH-向______极移动,该电池工作一段时间后,测得溶液的pH减小,则该电池总反应的离子方程式为______;
(3)甲醇对水质会造成一定的污染,用如图2所示的电化学法可消除这种污染,原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂再把水中的甲醇氧化成CO2而净化.则用该装置净化含10mol甲醇的水,转移电子数为______.
参考答案:(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO?(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
利用盖斯定律将①-②2+③可得:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ/mol;
(2)碱性甲醇燃料电池中,负极发生氧化反应,电极反应式为CH3OH-6e-+8OH-+=CO32-+6H2O,正极发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,该电池工作时,溶液中的OH-向负极移动,则总反应式为2CH3OH+3O2+4OH-=2CO32-+6H2O,
故答案为:O2+2H2O+4e-=4OH-;负;2CH3OH+3O2+4OH-=2CO32-+6H2O;
(3)甲醇氧化成CO2,C元素的化合价升高+6价,则10mol甲醇失去60mol电子,转移的电子数为60NA,故答案为:60NA.
本题解析:
本题难度:一般
3、实验题 20.(10分)某厂以重晶石(有效成分是BaSO4)为主要原料制取Ba(OH)2·8H2O晶体的示意图如下:

已知:i.BaSO4(s)+2C(s)=2CO2(g)+BaS(s) ΔH1=+226.2 kJ/mol
C(s)+CO2(g)=2CO(g) ΔH2=+172.5kJ/mol
ii.某些物质的溶解度(g/100g)简表
| 10℃
| 20℃
| 40℃
| 60℃
| 80℃
|
Ba(OH)2·8H2O
| 2.48
| 3.89
| 8.22
| 20.9
| 101
|
NaOH
| 98.0
| 109
| 129
| 174
| 314
|
NaCl
| 35.8
| 35.9
| 36.4
| 37.1
| 38.0
|
BaCl2
| 33.5
| 35.8
| 40.8
| 46.2
| 52.5
|
回答下列问题:
(1)炭与重晶石直接反应的热化学方程式是:BaSO4(s)+4C(s)=BaS(s)+4CO(g) ΔH=____kJ/mol。
(2)由BaCl2溶液可通过不同途径得到Ba(OH)2·8H2O。
途径1:

①得到固体1的离子方程式是______。
②固体2与水反应的化学方程式是______。
途径2:
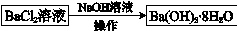
途径2中的“操作”是加热浓缩,冷却结晶,过滤。依据上述溶解度简表分析,过滤时的最佳温度是______;能从混合液中得到Ba(OH)2·8H2O晶体的原因是______。
(3)若向滤液1中加入CuO粉末,可直接得到含Ba(OH)2·8H2O晶体和CuS的浊液,反应化学方程式是______。将该浊液加热到80℃左右浓缩,趁热过滤,冷却滤液至室温,再过滤,即可得到Ba(OH)2·8H2O晶体。上述操作中趁热过滤的原因是______。
参考答案:(1)+571.2
(2)途径1:① CO32-+Ba2+ =BaCO3↓; ② BaO+9H2O=Ba(OH)2·8H2O
途径2:20℃或常温;20℃时4种物质中Ba(OH)2·8H2O溶解度最小
(3)BaS+CuO+9H2O=Ba(OH)2·8H2O+CuS;为减少过滤过程中Ba(OH)2·8H2O的损失
本题解析:(1)由于①BaSO4(s)+2C(s)=2CO2(g)+BaS(s) ΔH1=+226.2 kJ/mol
②C(s)+CO2(g)=2CO(g) ΔH2=+172.5kJ/mol
ΔH=①+2×②=226.2+2×172.5="571.2" kJ/mol
(2)①氯化钡溶液中加入碳酸钠固体,发生复分解反应,BaCl2+Na2CO3="Ba" CO3↓+ 2NaCl,则离子方程式为CO32-+Ba2+ =BaCO3↓;②BaCO3经灼烧后生成BaO,氧化钡溶于水生成氢氧化钡,化学反应方程式为BaO+9H2O=Ba(OH)2·8H2O;途径2中的“操作”是加热浓缩,冷却结晶,过滤。依据上述溶解度简表分析,过滤时的最佳温度是20℃左右,因为当温度升高后,氢氧化钡晶体的溶解度会逐渐增大;能从混合液中得到Ba(OH)2·8H2O晶体的原因是在20℃时4种物质中Ba(OH)2·8H2O溶解度最小,温度在20℃时氢氧化钡晶体以沉淀的形式析出;
(3)若向滤液1中加入CuO粉末,可直接得到含Ba(OH)2·8H2O晶体和CuS的浊液,反应化学方程式是BaS+CuO+9H2O=Ba(OH)2·8H2O+CuS;将该浊液加热到80℃左右浓缩,趁热过滤,冷却滤液至室温,再过滤,即可得到Ba(OH)2·8H2O晶体,操作中趁热过滤是为减少过滤过程中Ba(OH)2·8H2O的损失
考点:热化学方程式的计算、离子方程式的书写、工艺流程
点评:本题考查内容较丰富,注意离子方程式及化学方程式的书写,本题的关键是弄明白反应的流程。
本题难度:困难
4、选择题 一定条件下,氮氧化物?(NOx)形成的污染可以用甲烷来消除.已知:①CH4(g)+4NO2(g)-4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol②CH4(g)+4NO(g)-2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol下列选项正确的是( ? )
A.x=1.6时,每消除1mol氮氧化物需消耗0.5mol?CH4
B.CH4(g)+2NO2(g)-N2(g)+CO2(g)+2H2O(l);△H=>-867kJ/mol
C.若0.2molCH4还原NO2至N2,在上述条件下放出的热量为287?kJ
D.若用标准状况下2.24LCH4还原NO2至N2,整个过程中转移的电子为0.8mol
参考答案:D
本题解析:
本题难度:一般
5、选择题 已知:①H2O(g)=H2O(l) △H1=-Q1 kJ·mol—1;
②C2H5OH(g)=C2H5OH(l) △H2=-Q2 kJ·mol—1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ·mol—1
若使23g酒精液体完全燃烧,生成稳定的氧化物,最后恢复到室温,则放出的热量是多少kJ( )
A.Q1+ Q2+Q3
B.0.5(Q1+Q2+Q3)
C.0.5 Q1-1.5 Q2+0.5Q3
D.1.5Q1-0.5Q2+0.5Q3