|
高中化学必备知识点《热化学方程式》高频考点预测(2019年最新版)(六)
2019-06-28 22:29:39
【 大 中 小】
参考答案:A
本题解析:由于液态水的能量,低于气态水的能量,则氢气完全燃烧生成液态水时放热多,所以选项A符合;B中石墨比金刚石稳定,这说明石墨的总能量低于金刚石的总能量,所以金刚石燃烧放出的热量多;C中碳完全燃烧放热多;D中固态S的总能量低于气态S的总能量,所以气态S完全燃烧放热多,答案选A。
考点:考查反应热的有关计算和判断
点评:该题是高考中的常见题型和重要的考点,属于中等难度的试题。试题基础性强,主要是考查学生对影响反应热大小因素的熟悉掌握程度。该题的关键是明确反应热的大小只与反应物和生成物总能量的相对大小有关系,而物质的状态也和物质自身的能量有关系,然后结合题意灵活运用即可。
本题难度:简单
2、填空题 依据事实,写出下列的热化学反应方程式:
1molN2(g)与适量H2(g)起反应,生成NH3(g),放出92.2kj热量。
_____________________________________________________________________。
参考答案:N2(g) + 3H2(g) == 2NH3(g) ;△H = -92.2 KJ/mol
本题解析:
本题难度:一般
3、填空题 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
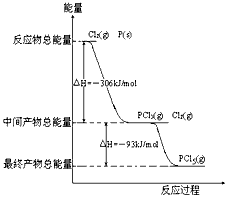
根据上图回答下列问题:
(1)PCl5分解成PCl3和Cl2的热化学方程式_________________________________
(2)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______
△H3(填“大于”、“小于”或“等于”)
参考答案:(1)PCl5(g)==PCl3(g)+Cl2(g);△H=+93kJ·mol-1
(2)-399kJ·mol-1;等于
本题解析:
本题难度:一般
4、填空题 红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)根据上图回答下列问题

(1)P和Cl2反应生成PCl3的热化学方程式:_______________________;
(2)PCl5分解生成PCl3和Cl2的热化学方程:______________________;温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6molPCl5,其分解率α1等于______________
(3)P和Cl2分两步反应生成1mol PCl5的△H3=_________; P和Cl2一步反应生成1mol PCl5的△H4______△H3(填“大于”,“小于”或“等于”) 。
参考答案:(1)P(s)+3/2Cl2(g)=PCl3(g) △H= -306kJ·mol-1
(2)PCl5(g)=PCl3(g)+Cl2(g) △H=+93 kJ·mol-1;25%
(3)-399kJ·mol-1;等于
本题解析:
本题难度:一般
5、选择题 25?℃,101?kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3?kJ/mol,辛烷的燃烧热为5?518?kJ/mol。下列热化学方程式书写正确的是
[?]
A.2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3?kJ/mol
B.KOH(aq)+1/2H2SO4(aq)===1/2K2SO4(aq)+H2O(l) ΔH=-57.3?k?J/mol
C.C8H18(l)+25/2O2(g)===8CO2(g)+9H2O ΔH=-5?518?kJ/mol
D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-5?518?kJ/mol
参考答案:B
本题解析:
本题难度:一般
|