1、选择题 一定温度下,在一定容的密闭容器中充入NO2发生如下反应:2NO2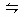 N2O4并达到平衡,此时NO2的转化率为P%,再次充入NO2,其转化率将(?)
N2O4并达到平衡,此时NO2的转化率为P%,再次充入NO2,其转化率将(?)
A.增大
B.减小
C.不变
D.无法确定
参考答案:A
本题解析:】将继续充入的NO2在另一个容器中建立与原平衡相等条件的等效平衡后,再将其和原平衡压缩在一起建立平衡。由此可见,充入NO2相当于增大原平衡的压强,NO2的转化率增大。
本题难度:一般
2、选择题 可逆反应X2(气)+Y2(气)?2XY(气),达到平衡的标志是( )
A.当温度和压强一定时,反应混合气平均分子量不再改变
B.当温度一定时,单位时间内生成2nmolXY,同时生成nmolY2
C.当温度一定时,容器总压强不随时间改变
D.当温度一定时,任何时间内X2和Y2的物质的量之比为定值
参考答案:A.平均分子量=总质量总物质的量,总质量不变,总物质的量也不变,故反应混合气平均分子量不再改变不能作为判断是否达到化学平衡状态的依据,故A错误;
B.生成2nmolXY是正反应,同时生成nmolY2为逆反应,且化学反应速率之比等于化学计量数之比,故正逆反应速率相等,故B正确;
C.反应前后气体的体积不变,故容器总压强不随时间改变不能作为判断是否达到化学平衡状态的依据,故C错误;
D.平衡时X2和Y2的物质的量之比取决于物质的起始物质的量和转化率,故任何时间内X2和Y2的物质的量之比为定值不能作为判断是否达到平衡状态的依据,故D错误,
故选B.
本题解析:
本题难度:简单
3、选择题 下列关于化学平衡的说法中,正确的是( )
A.当反应达到化学平衡状态时,反应物已完全转化为生成物
B.当反应达到化学平衡状态时,正逆反应均已停止
C.当反应达到化学平衡状态时,反应物与生成物中各成分的浓度保持不变
D.化学平衡是一定条件下的平衡,当条件改变时,平衡不会被破坏
参考答案:A、化学平衡是可逆反应,不能进行彻底,当反应达到化学平衡状态时,反应物不能完全转化为生成物,故A错误;
B、反应达到化学平衡状态时,正逆反应仍在进行,只是正逆反应速率相同,故B错误;
C、反应物与生成物中各成分的浓度保持不变是判断反应达到平衡的依据,故C正确;
D、平衡是一定条件下的平衡,条件改变,平衡可能发生移动,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 一定温度下的密闭容器中,不能表明A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
A.A的质量不再发生变化
B.混合气体的总物质的量不再发生变化
C.C的分子数目不再发生变化
D.D的物质的量浓度不再发生变化
参考答案:A、若A的质量不再发生变化,说明生成A和消耗A的速率相等,即正逆反应速率相等,达到了平衡状态,故A错误;
B、该反应方程式两边气体的体积不变,反应过程中气体的总物质的量始终不变,所以气体总物质的量不能作为判断平衡状态的依据,故B正确;
C、若C的分子数目不再发生变化,说明数目生成C和消耗C的反应速率相等,即正逆反应速率相等,达到了平衡状态,故C错误;
D、若D的物质的量浓度不再发生变化,说明正逆反应速率相等,达到了化学平衡状态,故D错误;
故选B.
本题解析:
本题难度:一般
5、选择题 在密闭容器中进行反应:H2(g) +I2(g) 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右图所示。符合图示的正确判断是
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右图所示。符合图示的正确判断是

A.T1>T2,ΔH>0
B.T1>T2,ΔH<0
C.T1<T2,ΔH>0
D.T1<T2,ΔH<0
参考答案:D
本题解析:温度越高,反应速率越快,反应达到平衡的时间越短,所以T1<T2,温度越高,产物的百分含量越低,说明正反应是放热反应即ΔH<0。答案为D项。
本题难度:简单