| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《热化学方程式》高频考点强化练习(2019年最新版)(六)
③若该反应的焓变为ΔH,则下列示意图正确且能说明反应达到平衡状态的是________。 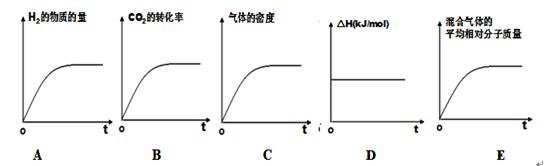 ④该条件下,此反应的化学平衡常数为 。 (3)科学家研究发现,还可以用电催化法将CO2还原为碳氢化合物。原理如下图所示(电解质溶液是一种钾盐)。若CxHy为C2H4,则该原理的总反应式为为: 。 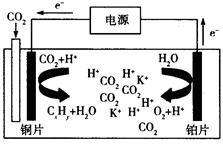 (4)已知
②向NaCN溶液中通入少量CO2,则发生反应的离子方程式为:________________。 参考答案:(15分). 本题解析:(1)甲醇燃烧的热化学方程式是CH3OH(l)+3/2O2(g)= CO2(g)+ 2H2O(l) ΔH= -726.5kJ/mol,氢气燃烧的热化学方程式是H2(g)+1/2O2(g)= H2O(l) ΔH= -285.8kJ/mol,根据盖斯定律,将氧气消去,下式乘以3减去上式可得氢气与二氧化碳反应生成甲醇的热化学方程式,答案为CO2(g)+3H2(g)=CH3OH(l)+H2O(l) ΔH=" -130.9" kJ/mol; 本题难度:困难 3、选择题 下列热化学方程式中,放出的热量最多的是 参考答案:B 本题解析: 本题难度:简单 4、填空题 恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g) 参考答案: 本题解析: 本题难度:困难 5、简答题 Ⅰ.在CaCO3沉淀中加入HCl溶液,有______现象,其离子反应式是______.沉淀溶解的原因是______. 参考答案:Ⅰ.碳酸钙是难溶性的弱酸盐,在水中存在的电离平衡为CaCO3?Ca 2++CO3 2-,酸和碳酸根离子反应生成水和二氧化碳,导致碳酸根离子浓度降低,平衡向正反应方向移动,从而使碳酸钙逐渐溶解,反应现象是沉淀溶解,有气泡逸出,发生的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑; 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《化学平衡状.. | |