|
高考化学试题《热化学方程式》高频试题特训(2019年最新版)(八)
2019-06-28 22:45:23
【 大 中 小】
|
1、选择题 下列说法不正确的是
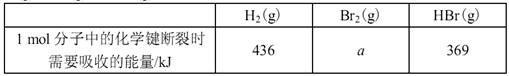
A.若2H2(g)+O2(g)=2H2O(g) ΔH=
|
参考答案:
本题解析:
本题难度:一般
2、填空题 A、B、C、D、E为前四周期中原子序数依次增大的元素,相关的信息如下:
元素
| 相关信息
| A
| A元素原子核外只有三个能级,且每个能级上含有相等的电子数
| B
| 是空气中含量最丰富的元素
| C
| 短周期中,单质C的金属性最强
| D
| 基态原子第三能层上有7种运动状态不同的电子
| E
| 一种核素的质量数为63,中子数为34
|
请用对应的元素符号回答下列问题:
(1)A与氢可形成一种的分子式为A2H4化合物,该分子中存在σ键与π键数目比为 。
(2)H—A、H—B两种共价键中,键能较大的是 ;H—A、H—D两种共价键中,键的极性较强的是
(3)E位于周期表中的位置是 ,单质E与B的最高价氧化物的水化物的稀溶液反应的离子方程式为 。
(4)根据下列能量变化示意图,请写出BO和AO2反应的热化学方程式 。

(5)C的最高价氧化物对应的水化物为M,M中含有的化学键类型为 。将一定量的D2通入一定浓度M的水溶液中,两者恰好完全反应时,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如上图所示。请写出t2时刻总反应方程式
参考答案:
25⑴5:1(2分)
⑵H-C (2分) H-Cl(2分) 第一空填H-C、H-N均可,
⑶第四周期第IB 族 (2分)
3Cu + 8H+ + 2NO3- = 3Cu2++2NO↑ + 4H2O(2分) 写成普通化学方程式,不得分;离子符号或化学式错,不得分;配平错,扣1分。
⑷NO(g)+ CO2(g)=NO2(g)+CO(g)
△H ="+234" kJ/mol(2分) 须正确标明物质状态、△H的数值、“+”号及单位,有一处错误即不得分。
⑸离子键、极性键 (2分) 各1分,“极性键”写成“共价键”或“极性共价键”也可。多填其它类型,每多填一个扣1分。
5Cl2+10NaOH = 7NaCl+2NaClO+NaClO3+5H2O(2分) 写离子方程式也可。化学式(或离子符号)错,不得分;配平错,扣1分。
本题解析:
根据信息可以推知A、B、C、D、E分别为C、N、Na、Cl、Cu元素。
(1)A2H4为乙烯,其结构简式为CH2=CH2,其σ键与π键数分别为5、1,故之比为5:1;
(2)键能跟键长有关系,键越断,键能越高,故有H—C<H—N;极性跟电负性有关,电负性越大,吸引力越大,极性越强,故H—C<H—Cl;
(3)为Cu与稀硝酸的反应
(4)从图中可以看出,生成物的总能量大于反应物总能力,故该反应为吸热反应,故有△H ="+234" kJ/mol;
(5)NaOH与氯气反应可能生成Cl-和ClO-或Cl-和ClO3-;从图中看出n(ClO-):n(ClO3-)=2:1,从而写出反应方程式。
考点:以物质结构理论为基础,考查了原子结构、分子结构、元素及化合物、氧化还原反应及热化学反应方程式的书写。
本题难度:困难
3、填空题 (10分)回答下列问题:
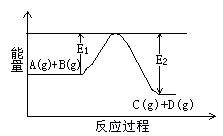
(1)反应A(g)+B(g) C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、 C(g)+D(g)过程中的能量变化如右图所示,判断该反应△H 0(填“>”、“<”、
或“无法确定”)。
(2)在Al2O3、Ni催化下气态甲酸发生下列反应:
甲酸(g)=" CO" (g)+ H2O (g) △H1=" +34.0" kJ/mol
甲酸(g)= CO2 (g)+ H2(g) △H2=" —7.0" kJ/mol
则甲酸的分子式为 ,在该条件下,气态CO2和气态H2反应生成气态CO和气态H2O的热化学方程式为 。
(3)如图所示,水槽中试管内有一枚铁钉,放置数天观察:

I若试管内液面上升,则正极反应: 。
II若试管内液面下降,则发生 腐蚀。
III若溶液甲为水,溶液乙为海水,则铁钉在 (填“甲”或“乙”)溶液中腐蚀的速度快。
参考答案:(10分)(1)<。(1分)
(2)CH2O2(1分),CO2(g) + H2(g) =" CO(g)" + H2O(g) △H = +41.0kJ/mol。(2分)
(3)IO2 + 2H2O + 4e-→ 4OH- 。(2分)II析氢。(2分)III乙。(2分)
本题解析:略
本题难度:一般
4、选择题 已知H-H键能436kJ/mol;Cl-Cl键能243kJ/mol;H-Cl键能431kJ/mol,则下列热化学方程式正确的是( )
A.H2(g)+Cl2(g)=2HCl(g)△H=-183?kJ/mol
B. H2(g)+Cl2(g)=HCl(g)△H=-124kJ/mol
C.2HCl(g)=H2(g)+Cl2(g)△H=-248?kJ/mol
D.HCl(g)=H2(g)+Cl2(g)△H=-91.5?kJ/mol
参考答案:反应为H2(g)+Cl2(g)=2HCl(g),反应的焓变=436kJ/mol+243kJ/mol-2×431kJ/mol=-183KJ/mol;
A、H2(g)+Cl2(g)=2HCl(g)△H=-183 kJ/mol,热化学方程式正确,故A正确;
B、系数减少一倍,焓变减少一倍,焓变应为-92,5KJ/mol,故B错误;
C、热化学方程式改变方向,焓变符号也要改变,焓变应为正值为183KJ/mol,故C错误;
D、依据分析热化学方程式方向改变,焓变符号改变应为正值,数值为原来的一半,故D错误;
故选A.
本题解析:
本题难度:简单
5、填空题 (1)稀强酸、稀强碱反应生成1mol液态水时放出57.3 kJ的热量。
① 实验室中可用稀盐酸和氢氧化钡稀溶液反应来测定中和热。请写出能表示该反应中和热的热化学方程式___________________________;
② 分别取100 mL 0.50 mol/L盐酸与100 mL 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。假设盐酸和氢氧化钠溶液的密度都是1g/cm3,中和后生成溶液的比热容
c = 4.18 J/(g·℃)。实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5℃,反应后混合溶液的温度为24.9℃。则实验测得的中和热△H=_______(保留1位小数);
③ 如果用含1 mol CH3COOH的稀醋酸与足量稀氢氧化钠溶液反应,反应放出的热量____________57.3 kJ(填“大于”、“小于”或“等于”);理由是_____________________________。
(2)在催化剂的作用下CH4还原NO可以得到三种产物(该条件下均为气体),利用此反应能消除环境污染物NO。理论上每消耗标况下22.4 L NO就能放出290kJ的热量。写出该反应的热化学方程式
___________________________。
参考答案:(1)① 1/2Ba(OH)2(aq)+HCl(aq) ==1/2BaCl2(aq)+H2O(l) △H =-57.3 kJ/mol;② △H=-56.8 kJ/mol;③ <;
醋酸的电离过程吸热
(2)CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1
本题解析:
本题难度:一般
| 