|
|
|
高考化学试题《热化学方程式》高频试题特训(2019年最新版)(一)
2019-06-28 22:45:23
【 大 中 小】
|
1、填空题 (14分) 2013年10月9日,2013年诺贝尔化学奖在瑞典揭晓,犹太裔美国理论化学家马丁·卡普拉斯、美国斯坦福大学生物物理学家迈克尔·莱维特和南加州大学化学家亚利耶·瓦谢尔因给复杂化学体系设计了多尺度模型而分享奖项。三位科学家的研究成果已经应用于废气净化及植物的光合作用的研究中,并可用于优化汽车催化剂、药物和太阳能电池的设计。
汽车尾气净化的主要原理为:2NO(g) + 2CO(g)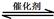 2CO2(g)+ N2(g) △H<0 2CO2(g)+ N2(g) △H<0
(1)同一条件下该反应正反应的平衡常数为K1,逆反应的表达式平衡常数为K2,K1与K2的关系式 。
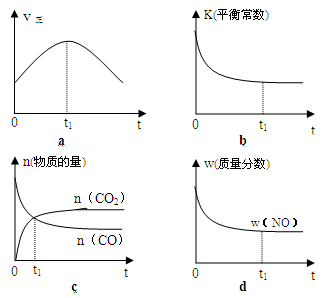
(2)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(3)在体积为10L的密闭容器中,加入一定量的CO2和H2,在900℃时发生吸热反应并记录前5min各物质的浓度,第6min改变了条件。各物质的浓度变化如下表;
时间/min
| CO2(mol/L)
| H2(mol/L)
| CO(mol/L)
| H2O(mol/L)
| 0
| 0.2000
| 0.3000
| 0
| 0
| 2
| 0.1740
| 0.2740
| 0.0260
| 0.0260
| 5
| 0.0727
| 0.1727
| 0.1273
| 0.1273
| 6
| 0.0350
| 0.1350
| 0.1650
|
|
①前2min,用CO表示的该化学反应的速率为 ;
②第5—6min,平衡移动的可能原因是 ;
(4)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) △H=-44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(5)在一定条件下,可以用NH3处理NOx。已知NO与NH3发生反应生成N2和H2O,现有NO和NH3的混合物1mol,充分反应后得到的还原产物比氧化产物多1.4 g,则原反应混合物中NO的物质的量可能是_____________。
(6)在一定条件下,也可以用H2可以处理CO合成甲醇和二甲醚(CH3OCH3)及许多烃类物质。当两者以物质的量1:1催化反应,其原子利用率达100%,合成的物质可能是 。
a.汽油 b.甲醇 c.甲醛 d.乙酸
2、选择题 完全燃烧一定质量的无水乙醇,放出的热量为Q,为完全吸收生成的CO2,并使之生成正盐Na2CO3,消耗掉0.8mol/L NaOH溶液500mL,则燃烧1mol酒精放出的热量是
A.0.2Q
B.0.1Q
C.5Q
D.10Q
|
3、选择题 下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)=C(金刚石) 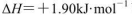 可知,金刚石比石墨稳定 可知,金刚石比石墨稳定
C.一定条件下,将0.5 mol N2(g)和1.5 molH2 (g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: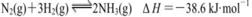
D.在稀溶液中, ,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ ,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
|
4、填空题 氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)500°C、50Mpa时,在容积为VL的密闭容器中加入n mol N2、3n mol H2,经过t min后反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值
为 ; t min内用NH3表示的速率是
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为 KJ/mol
2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为 KJ/mol
5、选择题 下列有关热化学方程式的叙述正确的是
[? ]
A.已知2H2(g)+O2(g) =2H2O(l);△H=-571.6kJ/mol,则氢气的燃烧热为285.8kJ/mol
B.已知C(石墨,s)= C(金刚石,s);△H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) △H=-57.4kJ/mol
D.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
 2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为 KJ/mol
2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为 KJ/mol