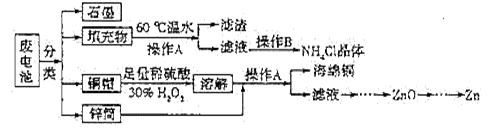|
|
|
高考化学知识点归纳《原电池原理》练习题(七)
2019-06-28 22:49:31
【 大 中 小】
|
1、选择题 在下图所示的原电池中,下列说法正确的是
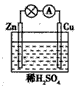
[? ]
A.负极发生还原反应
B.正极反应为Cu-2e-==Cu2+
C.电子由锌片通过导线流向铜片
D.该装置能将电能转化为化学能
2、选择题 原电池的电极名称不仅与电极的性质有关,也与电解质溶液有关,下列说法中不正确的是
A.有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3 e-=Al3+
B.Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3 e-=Al3+
C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Fe-2e-
|
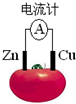
3、选择题 如图为番茄电池,下列说法正确的是( )
A.一段时间后,锌片质量会变小
B.铜电极附近会出现蓝色
C.电子由铜通过导线流向锌
D.锌电极是该电池的正极
|
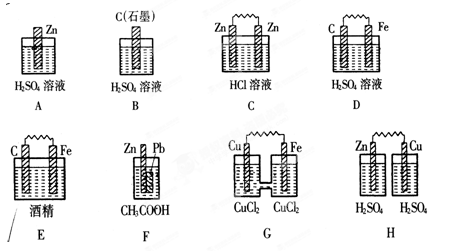
4、填空题 Ⅰ.在下图的装置中,属于原电池的是 。
Ⅱ.(1)如图所示,烧杯中为CuCl2溶液,在图中画出必要的连线或装置,使连接后的装置为原电池。电极反应方程式:

铁板: ;碳棒: 。
(2)铜片、锌片连接后浸入稀硫酸中构成原电池,当导线上通过3.01×1022个电子时,锌片质量减少________g。铜片表面析出氢气_________L(标准状况)。
5、填空题 (16分)常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
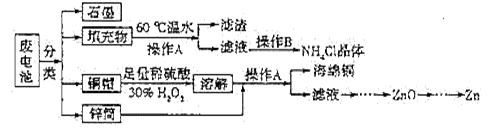
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=2MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
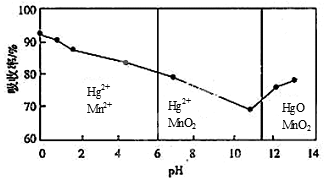
根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率__ _.
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强.