1、选择题 根据下列实验现象,所得结论错误的是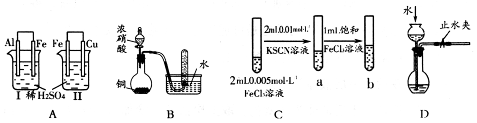

参考答案:B
本题解析:A、C、D三项正确,而B项由 Cu+4HNO3(浓)===?Cu(NO3)2+2H2O+2NO2↑,3NO2+H2O===2HNO3+NO?两道化学方应方程式可知试管收集到无色气体正确,但铜与浓硝酸的反应产物为NO2,不是NO,故B项 错误。
点评:实验装置与实验现象的试题具有相对灵活性,不仅考查学生的实验操作能力的认知,而且着重考查实验过程现象的观察能力,此类题型难度适中,考生应多加注意课本实验内容的熟练掌握。
本题难度:简单
2、选择题 利用下列试剂,选用合适方法鉴别Na2SO4、Na2SO3、Na2CO3、NaCl四种溶液,最佳试剂组是( )
A.BaCl2、HCl、石蕊溶液
B.BaCl2、HCl、品红溶液
C.AgNO3和HNO3溶液
D.AgNO3和BaCl2溶液
参考答案:A.加入BaCl2溶液分别生成BaSO4、BaSO3、BaCO3沉淀,BaSO3和BaCO3溶于盐酸,并且BaSO3与盐酸反应生成刺激性气味的SO2气体,而BaCO3与盐酸反应无色无味的CO2,SO2和CO2都能是石蕊试液变红,鉴别效果不好,故A错误;
B.在Na2SO4、Na2SO3、Na2CO3、NaCl中滴加BaCl2和HCl.Na2SO4生成沉淀不溶解;NaCl不生成沉淀;Na2SO3、Na2CO3生成沉淀后都溶解,但Na2SO3生成的气体可以使品红褪色,而Na2CO3不能,可鉴别,故B正确;
C.加入AgNO3和HNO3溶液,Na2SO3被氧化为Na2SO4,不能鉴别,故C错误;
D.加入AgNO3和BaCl2溶液,都生成白色沉淀,不能鉴别,故D错误.
故选B.
本题解析:
本题难度:简单
3、选择题 按下述实验方法制备气体,合理而实用的是( )
A.锌粒与稀HNO3反应制备H2
B.电解熔融的Al2O3制备O2
C.固体MnO2与浓HCl反应制备Cl2
D.大理石与浓H2SO4反应制备CO2
参考答案:C
本题解析:略
本题难度:简单
4、实验题 (14分)某研究小组对铁生锈进行研究:

(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是?(填字母),铁锈的主要成分是?
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为?
(3)铁生锈的外部条件是??;在此条件下,铁钉发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为?
(4)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是?
A. 锡? B. 铜? C. 锌?
(5)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下:

①步骤Ⅲ用除锈液(15%的硫酸溶液)浸泡铁件的目的在于除去铁表面的铁锈,该步反应的离子方程式为___________________________________。
②为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
③除锈后的铁件在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应:
反应一:____Fe +____NaNO2 +___NaOH —____Na2FeO2 +____H2O +___NH3↑
反应二:8Fe+3NaNO3 + 5NaOH + 2H2O = 4Na2Fe2O4 + 3 NH3↑
反应三:Na2FeO2 + Na2Fe2O4 + 2H2O = Fe3O4 + 4NaOH
配平“反应一”的化学方程式(将系数直接填在横线上)。若要循环使用发蓝液,从理论角度分析,需要往使用过的发蓝液中_________
A. 只需加入NaNO2? B. 只需加入NaNO2和NaNO3
C. 需要加入NaNO2、NaNO3和NaOH? D. 不需加入任何物质而直接使用
参考答案:(14分)(1)A,? Fe2O3(或 Fe2O3· xH2O)
(2)O2+2 H2O+4e-= 4 OH-
(3)潮湿的空气(或氧气与水);? 2Fe +O2 +2 H2O=2 Fe(OH)2
(4)C?(5)① Fe2O3+6 H+=2 Fe3++3 H2O
②铁制品表面有红色固体析出③ 3、1、5、3、1、1;B
本题解析:(1)B、C都不能隔绝空气,防止铁发生电化学腐蚀,而A不能,所以最容易倍腐蚀的是A。铁锈的主要成分是Fe2O3(或 Fe2O3· xH2O)。
(2)在铁的电化学腐蚀中,铁作负极,由于溶液的酸性很弱,所以正极是氧气得到电子,即反应式为O2+2 H2O+4e-= 4 OH-。
(3)铁要腐蚀电化学腐蚀,则必须处在潮湿的空气(或氧气与水),反应的总反应式是2Fe +O2 +2 H2O=2 Fe(OH)2.
(4)由于镀层一旦败损之后容易腐蚀电化学腐蚀,所以作镀金属性比铁强的金属,所以答案选C。
(5)①铁锈的主要成分是氧化铁,和稀硫酸反应的方程式为Fe2O3+6 H+=2 Fe3++3 H2O。
②因为铁的活泼性强于铜,铁能和硫酸铜反应置换出铜,所以铁制品表面有红色固体析出。
③在反应中铁失去电子作还原剂,化合价从0价升高到+2价。氧化剂是亚硝酸钠,氮元素的化合价从+3价降低到-3价,变化6个单位,即氧化剂和还原剂的物质的量之比是1︰3的,所以方程式为3Fe +NaNO2 +5NaOH=3Na2FeO2 +H2O +NH3↑。将3个反应合并即得到12Fe+NaNO3+4NaNO2+10H2O=4Fe3O4+5NH3↑+5NaOH,这说明反应中消耗的是硝酸钠和亚硝酸钠,所以需要补充二者,答案选B。
本题难度:一般
5、简答题 【化学与技术】
将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
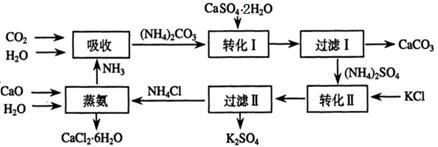
(1)本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要?等原料。
(2)石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式为?。
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有?(填化学式)等物质,该固体可用作生产水泥的原料。
(4)检验过滤Ⅰ所得滤液中含有CO32-的方法是?。
(5)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是?。
a.熔点较低(29℃熔化)? b.能导电? c.能制冷? d.无毒
(6)上述工艺流程中体现绿色化学理念的是?。
参考答案:(1)CaCO3、NH3、H2O
(2)CaSO4+CO32-=CaCO3+SO42-?
(3)CaSO4
(4)滤液中滴加盐酸产生气泡?
(5)ad
(6)碳酸钙用于制取水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中)
本题解析:(1)根据流程可知,需要生石灰、二氧化碳、氨气、水、碳酸钙高温分解即生成氧化钙和二氧化碳,所以本工艺中所用的原料除CaSO4·2H2O、KCl外,还需要CaCO3、NH3、H2O等原料。
(2)碳酸钙的溶解度小于硫酸钙,因此根据沉淀转化原理知,石膏悬浊液中加入碳酸铵溶液后发生的离子方程式为CaSO4+CO32-=CaCO3+SO42-。
(3)硫酸钙微溶于水,所以过滤I操作所得固体中,除CaCO3外还含有CaSO4等物质。
(4)由于碳酸盐能和盐酸反应产生二氧化碳气体,所以检验过滤I所得滤液中含有CO32-的方法是滤液中滴加盐酸产生的气泡。
(5)储热材料与物质的导电性以及能否制冷无关系,而与自身的熔点高低和有无毒性无关系,所以选ad。
(6)根据流程图知,工艺流程中体现绿色化学理念的是反应中产生的碳酸钙用于制取水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等。
本题难度:一般