1、实验题 (10分)下图是硫酸试剂瓶标签上的内容:

(1)该硫酸的物质的量浓度为________ mol·L-1。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol·L-1的稀H2SO4,则需取________ mL的该硫酸,将上述硫酸进行稀释的实验操作为
________________________________________________________________________。
(3)在配制4.6 mol·L-1的稀H2SO4的过程中,下列情况对硫酸溶液物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)
①未经冷却趁热将溶液注入容量瓶中:________;
②容量瓶用1 mol·L-1的稀H2SO4润洗:________;
③定容时俯视液面读数:________。
参考答案:(1)18.4
(2)60 将浓硫酸沿器壁缓慢注入水中,并不断用玻璃棒搅拌溶液
(3)①偏高 ②偏高 ③偏高
本题解析:(1)由溶质的质量分数求物质的量浓度时可依据公式c=来计算,代入数据可求得,c=18.4mol·L-1;
(2)由稀释前后溶质的物质的量不变可知,18.4mol·L-1×V=4.6mol·L-1×0.24 L,则V=0.06 L;
(3)未经冷却趁热将溶液注入容量瓶中,冷却后造成溶液体积变小,导致溶液浓度偏高;容量瓶用1mol·L-1的稀H2SO4润洗,溶质的物质的量变大,导致溶液浓度偏高;定容时俯视液面读数,加水量减少,结果偏高。
本题难度:简单
2、简答题 碳酸钙常用作牙膏的摩擦剂.某同学设计了一种制备碳酸钙的方案,其流程图如下.(所用石灰石含有杂质SiO2)

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨.标准状况下生成二氧化碳的体积为______L,石灰石中碳酸钙的质量分数为______%.
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶液性滤渣的成分为______.
(3)第③步反应一般不采用通入CO2的主要原因是______,相应的离子方程式为______.
(4)CaCO3是一种难溶液物质,25℃时其KSP=2.8×10-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是______.
(5)某生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下
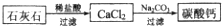
与前一方案相比较,该方案的优点是______.
参考答案:(1)根据碳酸钙分CaCO3 ?高温?.??CaO+CO2↑△m
? 100?56?44? 44
?100×106g? 44×106?g? 44×106g
? 所以生成二氧化碳的体积为44×10644mol×22.4L/mol=2.24×107 L,
?石灰石中碳酸钙的质量分数为100×106110×106× 100%=90.9%
? 故答案为:2.24×107? 90.9?
? (2)碳酸钙除了分解,还与SiO2发生反应:SiO2+CaCO3 =CaSiO3+CO2SiO2+CaCO3?高温?.? CaSiO3+CO2↑,所以SiO2+CaCO3 =CaSiO3+CO2不溶液性滤渣的成分
CaSiO3,故答案为:CaSiO3;
SiO2+CaCO3 =CaSiO3+CO2
? (3)因CO2过量时,会继续与碳酸钙反应,
故答案为:通入CO2的量不易控制,使生成的碳酸钙在CO2过量的条件下溶解;CaCO3+CO2+H2O═Ca2++2HCO3-
?(4)因QC≥KSP时,形成沉淀,C(Ca2+)≥2.8×10-91×10-4mol?L-1=2.8×10-5mol?L-1,等体积混合前CaCl2溶液的物质的量浓度最小为5.6×10-5 mol?L-1,故答案为:5.6×10-5 mol?L-1
? (5)因与前一方案相比较,可知制备过程不需要加热、操作简便等,故答案为:不需要加热,操作简便,减少来自燃料的污染
本题解析:
本题难度:一般
3、实验题 水滑石化学式为:[Mg6Al2(OH)16CO3]·4H2O(相对分子质量为602),是环保型阻燃剂。它受热时生成4种不同的氧化物,请写出该物质分解的化学方程式:?。
在医药上,水滑石还能作为抗酸药,作用于胃和十二指肠溃疡等,某研究型学习小组要测定一种市售的水滑石药片中水滑石的质量分数。
【查阅资料】水滑石与稀硫酸反应的化学方程式为:
[Mg6Al2(OH)16CO3]·4H2O+9H2SO4==6MgSO4+Al2(SO4)3+CO2↑+21H2O。药片中除了水滑石外含有一定量的辅料——淀粉等物质。
【提出猜想】小华想将该药片放在空气中充分灼烧完成测定;小明想通过水滑石与硫酸反应原理来完成测定,请你参与探究。
【设计方案】他们设计了不同的实验方案。
小华的方案,称取10.0g市售的水滑石药片研磨成粉末置于通风橱中,充分灼烧至质量不再减少,再称量剩余固体的质量为6.1g,减少的质量即为二氧化碳和水的总质量,则可求的水滑石药片中水滑石的质量分数为?%。
小明的方案:
(1)小明设计了下图所示的实验装置。取10.0g市售的水滑石药片研磨成粉末,进行实验。
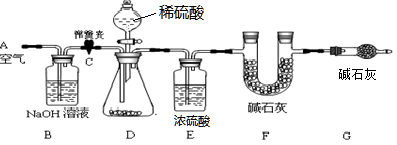
【说明】碱石灰是氧化钙和氢氧化钠固体的混合物。B装置中发生的化学方程式为?。
(2)操作步骤
①连接好装置,检查装置的气密性②打开弹簧夹C,在A处缓缓通入一段时间的空气③称量F的质量④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出⑤打开弹簧夹C,再次缓缓通入一段时间空气⑥再次称量F的质量,得前后两次质量差为0.44g。
(3)问题探究
B、E装置的作用分别是?、?。若没有G装置,则测定的水滑石的质量分数会?(填“偏大”、“偏小”、“不变”)。实验选用稀硫酸而不选用稀盐酸的理由是?。
(4)数据计算
根据实验数据,可求得水滑石药片中水滑石的质量分数为?%。(写出计算过程)
【方案评价】在上述实验方案中,你认为合理的实验方案是?(填小华或小明),另一个方案不合理的原因是?。
参考答案:(12分)[Mg6Al2(OH)16CO3]·4H2O ?△?6MgO+Al2O3+CO2↑+12H2O↑? 90.3%
(1) CO2+ 2NaOH="=" Na2CO3+H2O
(3)除尽空气中的CO2,排除干扰;除尽CO2中的水蒸气,排除干扰;?防止空气中的二氧化碳和水进入F装置而影响测定;偏大;选用稀盐酸会因反应放热而使HCl气体挥发,使进入F装置的气体中混有HCl气体,而影响测定。
(4)设含[Mg6Al2(OH)16CO3]·4H2O质量 X
[Mg6Al2(OH)16CO3]·4H2O~CO2?……………………1分
602? 44
x? 0.44 g
602∶x =" 44" ∶0.44 g?……………………1分
x =60.2%?……………………1分;
小明 ;灼烧后辅料中的淀粉也会产生二氧化碳和水,导致质量分数偏大
本题解析:根据题中所给出的反应物的组成分析,该物质分解的化学方程式是[Mg6Al2(OH)16CO3]·4H2O ?△?6MgO+Al2O3+CO2↑+12H2O↑。
根据差量法计算,固体减少的质量是CO2和12H2O的质量。
[Mg6Al2(OH)16CO3]·4H2O ?△?6MgO+Al2O3+CO2↑+12H2O↑? ?m
602?260
m? 10.0g-6.1g=3.9g
602*3.9g=260m
解得m=9.03g
故水滑石药片中水滑石的质量分数为(9.03g/10.0g)*100%=90.3%。
(1)空气中的CO2会和NaOH溶液反应,方程式为CO2+ 2NaOH="=" Na2CO3+H2O。
(3)空气中的CO2会和NaOH溶液反应,故B装置的作用是除尽空气中的CO2,排除干扰。浓硫酸能吸收水份,故E装置的作用是除尽CO2中的水蒸气,排除干扰。G装置是防止空气中的CO2进入,故没有G装置,则测定的水滑石的质量分数会偏大。稀盐酸易挥发而稀硫酸不易挥发。
(4)设含[Mg6Al2(OH)16CO3]·4H2O质量 X
[Mg6Al2(OH)16CO3]·4H2O~CO2?……………………1分
602? 44
x? 0.44 g
602∶x =" 44" ∶0.44 g?……………………1分
x =60.2%?……………………1分;
小明 ;灼烧后辅料中的淀粉也会产生二氧化碳和水,导致质量分数偏大
点评:综合实验既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练,特别是对实验的设计和评价,更是重中之重。
本题难度:一般
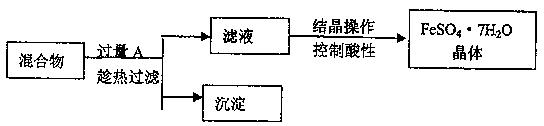
4、填空题 某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:
请根据题目要求回答下列问题:
(1)A的化学式为?,上述操作过程中用到的玻璃仪器有:①烧杯、②③玻璃棒、③酒精灯、④温度计、⑤?。
(2)趁热过滤的目的是?。
(3)结晶操作过程中应控制滤液酸性的原因是____?
(4)已知硫酸亚铁铵[(NH4)2Fe (SO4)2]比硫酸亚铁稳定,用在分析化学中。硫酸亚铁铵可用硫酸铵和硫酸亚铁反应制得。实验室利用硫酸亚铁铵溶液和草酸溶液反应生成草酸亚铁沉淀来制备草酸亚铁。写出硫酸亚铁铵溶液与草酸溶液反应的离子方程式____?。
(5)草酸亚铁晶体(相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。
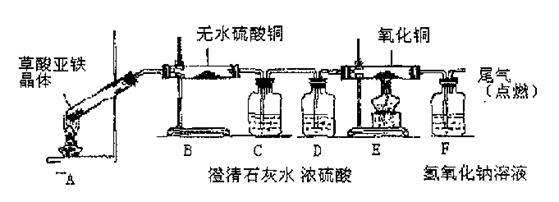
①该装置中最不合理的部分?(填字母),原因是?。
②改用正确装置实验开始后,B处变蓝,说明草酸亚 铁晶体中有?;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生?(填化学式)。
铁晶体中有?;C处有白色沉淀,E处部分黑色粉末变为红色,说明草酸亚铁分解产生?(填化学式)。
参考答案:(1)Fe? 1分,漏斗? 1分?
(2)防止硫酸亚铁晶体析出? 1分
(3)防止Fe2+水解1分?
(4) Fe2++H2C2O4→FeC2O4↓ +2H+? 2分
(5)①A? 1分;试管口向上,反应生成的水倒流入试管会使试管破裂,故试管口应略向下? 2分
②结晶水? 1分?,CO2、CO? 2分
本题解析:略
本题难度:一般
5、实验题 如图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化。

(1)实验开始时应先将活塞a________(填“打开”或“关闭”)。
(2)简述生成Fe(OH)2的操作过程__________。
(3)实验完毕,打开b处活塞,放入一部分空气,此时B瓶中发生的反应为______________。
(4)下列各图示中_____能较长时间看到Fe(OH)2白色沉淀。
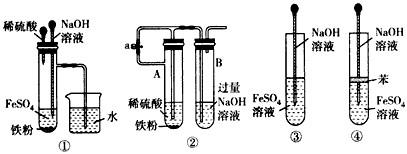
参考答案:(1)打开
(2)关闭活塞a,使FeSO4溶液压入B中进行反应
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(4)①②④
本题解析:
本题难度:一般