1、选择题 下列实验操作正确的是(?)
A.将氢氧化钠固体放在滤纸上称量
B.用10ml量筒量取8.58ml蒸馏水
C.制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集
D.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
参考答案:D
本题解析:
【错解分析】本题多数同学易错选B项,原因是对量筒的精确度把握不够。也有同学会误选A项,主要是没考虑到氢氧化钠在空气中易潮解且有腐蚀性。
【正解】本题考查的是实验的基本操作,做好这类题要掌握如下一些知识点:
1.几个“先后 ”加热操作、制取气体操作、收集气体、中和滴定、焰色反应等。
2.几个“零”滴定管的零刻度、量筒及容量瓶没有零刻度、托盘天平、温度计等。
3.几个“数据”几种仪器的精确度如托盘天平、滴定管、量筒等。
选项A中正确的做法是将氢氧化钠放在玻璃器皿(如烧杯中)称量。选项B可以用移液管或滴定管能实现。选项C. 是浓盐酸与二氧化锰在加热条件下反应,用排空气法或排饱和食盐水法收集。
本题难度:简单
2、实验题 下图是某学生设计的实验室制备干燥Cl2及吸收多余氯气的实验装置图,请回答:
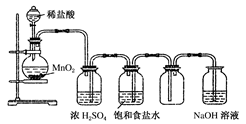
(1)指出上述图中的各处错误:
①_________________________________________________________;
②_________________________________________________________;
③_________________________________________________________;
④________________________________________________________。
(2)在改过后的装置中,下列物质的作用分别是:
①饱和食盐水_________________________________________;
②浓硫酸____________________________________________;
③NaOH溶液_________________________________________。
参考答案:(1)①不能用稀盐酸,而应用浓盐酸 ②应有加热装置,应用酒精灯加热 ③盛浓硫酸和盛饱和食盐水的洗气瓶位置颠倒 ④两洗气瓶里进气导管和出气导管的长短不对(2)①除去Cl2中的氯化氢 ②除去氯气中的水蒸气 ③吸收多余的氯气
本题解析:(1)实验室制取氯气需要浓盐酸,并在加热的条件下进行。生成的氯气中含有水蒸气和氯化氢,应该先除氯化氢,后除水蒸气,且应该是长口进,短口出,所以错误有①不能用稀盐酸,而应用浓盐酸 ②应有加热装置,应用酒精灯加热 ③盛浓硫酸和盛饱和食盐水的洗气瓶位置颠倒 ④两洗气瓶里进气导管和出气导管的长短不对。
(2)①氯化氢极易溶于水,所以饱和食盐水的作用是除去Cl2中的氯化氢。
②浓硫酸具有吸水性,因此浓硫酸的作用是除去氯气中的水蒸气。
③氯气有毒,需要尾气处理,则氢氧化钠溶液的作用是吸收多余的氯气。
点评:该题以氯气的制取载体,侧重对学生实验能力的考查,涉及装置的选择、气体的净化、除杂、收集、尾气处理以及实验分析与评价,有利于培养学生规范、严谨的实验设计能力,有利于提升学生的学科素养。明确实验原理是答题的关键。
本题难度:一般
3、实验题 某同学为了探究硫与氧气的反应情况,装配好如图所示得装置,待内外空气压强不变时标注出水银液面的刻度(用红漆)。取下橡皮塞,在玻璃燃烧匙中加入硫粉,用酒精灯点燃迅速移入锥形瓶中并塞紧橡皮塞。硫粉安静地燃烧,水银柱推向左管。当火焰熄灭后,静置,水银柱又慢慢地回到原先标定的刻度。简要回答下列问题:
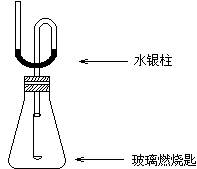
(1)水银柱推向左管说明什么?
_______________________________________________。
(2)硫粉未燃尽时火焰就熄灭了,说明_________________________________。
(3)根据水银柱最后又回到原先标定的刻度,可得到什么结论?
__________________________________________________________________。
(4)根据反应方程式S + O2 ="=" SO2和上述结论又可推导出什么?(或证明什么?)
_______________________________________________________________________。
参考答案:(1)①该反应是放热反应;②气体受热膨胀?
(2)瓶内氧气已耗尽
(3)①同温同压下,反应消耗的氧气与生成的SO2体积相同;②压强相同;③物质的量相同?
(4)同温同压下,相同体积的气体含有相同的分子数
本题解析:本题联系物理学中气体压强知识,考查基本化学反应。水银柱的存在,将锥形瓶中气体隔为一密闭体系。当水银柱推向左管时,说明锥形瓶中气体膨胀,由于反应:S + O2 ="=" SO2,看出反应前后气体体积没有变化,因此唯一的可能就是该反应放热。
当过一段时间后,锥形瓶中气体通过玻璃壁与外界进行了热传递,恢复到原来温度,这时气体的体积与原来的体积一样,即压强没有改变,因此水银柱又回到原先标定的刻度。
本题难度:简单
4、选择题 (双选)下列实验方法正确的是
A.用无水乙醇提取碘水中的碘单质
B.加入稀HNO3和BaCl2溶液产生白色沉淀的溶液中一定含SO42-
C.可用FeCl3溶液一次性鉴别CCl4、苯酚溶液、NaI溶液和NaCl溶液
D.玻璃棒在配制0.1mol/L NaCl溶液与粗盐提纯的实验中所起的作用相同
参考答案:CD
本题解析:乙醇与水混溶不分层,不适合作碘水的萃取剂,应选择四氯化碳或苯,故A错误;稀硝酸具有强氧化性,能将亚硫酸根离子氧化为硫酸根离子,且银离子与氯化钡反应生成的白色氯化银沉淀不溶于稀硝酸,因此可溶性银盐溶液、亚硫酸盐溶液、硫酸盐溶液都能产生相同的现象,应先滴入适量盐酸无明显变化,后滴入少量氯化钡溶液产生白色沉淀,说明待测溶液中一定含有硫酸根离子,故B错误;向四种待测溶液中分别加入适量氯化铁溶液,出现分层现象的是四氯化碳,溶液变为紫色的是苯酚溶液,溶液由无色变为褐或黄色的是碘化钠溶液,无明显变化的是氯化钠溶液,因为四氯化碳不溶于水、密度比水大,苯酚遇氯化铁溶液变紫色,铁离子将碘离子氧化为单质碘,故C正确;配制一定物质的量浓度溶液时,玻璃棒其搅拌、引流作用,粗盐提纯过程中,玻璃棒先后起搅拌、引流作用,故D正确。
本题难度:简单
5、实验题 某同学旅游时发现,苗族人的银饰美丽而富有民族文化,制作银饰时可以选用Fe(NO3)3溶液做蚀刻剂。受此启发,该同学所在的化学兴趣小组在实验室选用Fe(NO3)3溶液清洗做过银镜反应的试管,发现不但银镜溶解,而且较少产生刺激性气体。
化学兴趣小组对Fe(NO3)3溶液溶解银的原理进行探究:
【提出假设】假设1: Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag;
假设2:Fe3+具有氧化性,能氧化Ag
【验证假设】
(1)甲同学验证假设1。
①他用淡紫色的Fe(N03)3·9H20晶体(分析纯,Mr=404)配制1.5mol/L的Fe(N03)3落液100mL。需要称取_____g Fe(N03)3·9H20晶体,配制过程中所用到的仪器除烧杯、玻璃棒外还必需:__________
②测得1.5?mol/L的Fe(NO3)3溶液pH约为1,其原因用化学用语表示为____。
③将pH=1的HN03溶液加入到镀有银镜的试管中,振荡,观察到银镜慢慢溶解,产生无色气体并在液面上方变为红棕色,溶液中发生反应的离子方程式应是_____
④将1.5mol/L的Fe(NO3)3溶液加入到镀有银镜的试管中,振荡,观察到银镜很快溶解,并且溶液颜色加深。
(2)乙同学验证假设2。分别用溶质的质量分数为2%、10%的足量FeCl3溶液加入到镀有银镜的试管中,振荡,都看不出银镜溶解。乙同学由此得出结论,假设2不成立。
你是否同意乙的结论?_______,简述理由:_______
【思考与交流】I甲同学的实验④中,溶液颜色为什么会加深?查阅资料得知,Fe2+能与NO形成配离子: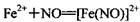 (棕色)。已知,同浓度的硝酸氧化性比Fe3+略强。
(棕色)。已知,同浓度的硝酸氧化性比Fe3+略强。
根据以上信息综合分析,浓、稀Fe(N03)3溶液溶解银镜时,发生的反应有何不同?
__________________________________________
参考答案:(共16分)?
【验证假设】(1)①60.6(2分)? 100?mL容量瓶、胶头滴管(2分)?
②Fe3++3H2O Fe(OH)3+3H+(2分)?③3Ag+NO3-+4H+=3Ag++NO↑+2H2O(2分)
Fe(OH)3+3H+(2分)?③3Ag+NO3-+4H+=3Ag++NO↑+2H2O(2分)
(2)不同意(2分)?没有检验是否生成了Fe2+,可能是Fe3+与Ag发生了反应,但生成的Ag+与Cl-形成沉淀阻止了反应继续进行,也可能是FeCl3?溶液浓度太小而不能溶解银(3分)
【思考与交流】Fe(NO3)3浓溶液中,Fe3+、NO3-都氧化了Ag,Fe(NO3)3稀溶液中可能只有NO3-氧化了Ag(3分)
本题解析:【验证假设】(1)①m(Fe(N03)3·9H20)=1.5mol/L×0.100L×404g/mol=60.6g;配制过程中所用到的仪器除烧杯、玻璃棒外还必需100?mL容量瓶、胶头滴管;②三价铁离子水解造成溶液显酸性,Fe3++3H2O Fe(OH)3+3H+。③根据反应物和生成物,不难写出相关离子方程式3Ag+NO3-+4H+=3Ag++NO↑+2H2O;(2)没有检验是否生成了Fe2+,可能是Fe3+与Ag发生了反应,但生成的Ag+与Cl-形成沉淀阻止了反应继续进行,也可能是FeCl3?溶液浓度太小而不能溶解银;【思考与交流】根据同浓度的硝酸氧化性比Fe3+略强,Fe(NO3)3浓溶液中,Fe3+、NO3-都氧化了Ag,Fe(NO3)3稀溶液中可能只有NO3-氧化。
Fe(OH)3+3H+。③根据反应物和生成物,不难写出相关离子方程式3Ag+NO3-+4H+=3Ag++NO↑+2H2O;(2)没有检验是否生成了Fe2+,可能是Fe3+与Ag发生了反应,但生成的Ag+与Cl-形成沉淀阻止了反应继续进行,也可能是FeCl3?溶液浓度太小而不能溶解银;【思考与交流】根据同浓度的硝酸氧化性比Fe3+略强,Fe(NO3)3浓溶液中,Fe3+、NO3-都氧化了Ag,Fe(NO3)3稀溶液中可能只有NO3-氧化。
本题难度:一般