|
高考化学必考知识点《难溶电解质的溶解平衡》考点特训(2019年冲刺版)(二)
2019-07-03 22:57:33
【 大 中 小】
|
1、选择题 化学知识与日常生活密切相关。下列说法不正确的是
A.镀锡铁板比镀锌铁板更耐腐蚀
B.水常温下呈液态,冰浮在水面上,均与氢键有关
C.用纯碱溶液清洗油污时,加热可增强其去污能力
D.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
|
参考答案:A
本题解析:A.金属活动性Zn>Fe>Sn,所以镀锡铁板不如镀锌铁板更耐腐蚀,错误;B.水常温下呈液态是由于分子之间存在氢键,增加了分子之间的吸引力,冰浮在水面上,由于分子之间存在氢键,由于氢键的存在,增加了分子之间的距离,使其密度比水小,故均与氢键有关,正确;C.纯碱是盐,水解是溶液显碱性,因此可以洗涤油污。由于加热可以促进盐的水解平衡正向移动,使溶液的碱性增强,故用纯碱溶液清洗油污时,加热可增强其去污能力,正确;D.锅炉水垢中含有的CaSO4,CaSO4在溶液中存在沉淀溶解平衡,当向其中加入Na2CO3溶液时,会形成溶解度更小的CaCO3,发生沉淀的转化,然后再加入盐酸,CaCO3与盐酸发生复分解反应,产生可溶性的钙盐,而达到除去杂质的目的,正确。
考点:考查化学知识在日常生活中的应用的知识。
本题难度:一般
2、计算题 铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(
参考答案:
本题解析:
本题难度:困难
3、选择题 将足量BaCO3分别加入:
①30 mL水
②10 mL 0.2 mol/L Na2CO3溶液
③50 mL 0.01 mol/L氯化钡溶液
④100 mL 0.01 mol/L盐酸中溶解至溶液饱和。各溶液中Ba2+的浓度由大到小的顺序为(? )
A.①②③④
B.③④①②
C.④③①②
D.②①④③
参考答案:B
本题解析:③中c(Ba2+)≈0.01 mol/L;④中BaCO3和盐酸发生反应后c(Ba2+)≈0.005 mol/L;②中存在同离子效应,故其中的c(Ba2+)小于在纯水中的c(Ba2+)。
本题难度:一般
4、填空题 已知:
①25℃时弱电解质的电离平衡常数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:Ksp(CaF2)=1.5×10-10。
②25℃时,2.0×10-3mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
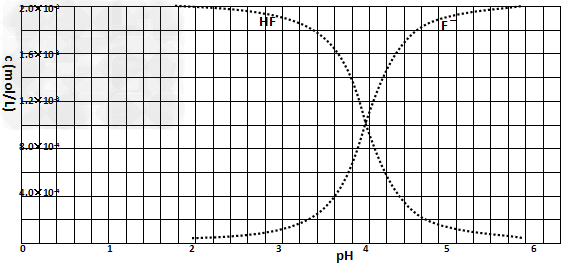
请根据信息回答下列问题:
(1)25℃时,将20mL?0.10?mol/L?CH3COOH溶液和20mL?0.10?mol/LHSCN溶液分别与20mL?0.10?mol/LNaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图如下图:
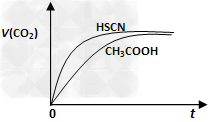
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是______________,反应结束后所得两溶液中,c(CH3COO-)_______c(SCN-) (填“>”、“<”或“=”)。
(2)25℃时,HF电离平衡常数的表达式Ka=_______, 25℃时,HF电离平衡常数Ka______。
(3)25℃时,将4.0×10-3?mol/LHF溶液与4.0×10-4?mol/L?CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过列式计算说明是否有沉淀产生_____________?。
参考答案:(1)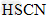 的酸性比 的酸性比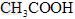 强,其溶液中 强,其溶液中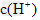 较大,故其溶液与 较大,故其溶液与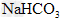 溶液的反应速率快;< 溶液的反应速率快;<
(2)Ka=[c(F-)·c(H+)]/c(HF);10-3.4
(3)25℃时,4.0×10-3?mol·L-1HF溶液与4.0×10-4?mol·L-1?CaCl2溶液等体积混合,则HF溶液浓度为2.0×10-3mol·L-1,CaCl2溶液浓度为2.0×10-4mol·L-1;查图知pH=4时,溶液中c(F-)浓度为1.8×10-3? 所以c(Ca2+)×c2(F-)=2.0×10-4×(1.8×10-3)2=6.48×10-10>Ksp(CaF2),有沉淀产生。
本题解析:
本题难度:一般
5、选择题 已知H2CrO4是弱酸,在一饱和Ag2CrO4水溶液(含有Ag2CrO4固体)中,添加下列试剂能使c(CrO42-)减少的是
[? ]
A. NH3
B. 硝酸
C. 水
D. AgNO3
参考答案:BD
本题解析:
本题难度:一般
|