1、填空题 醋酸银是白色的闪光结晶体,不易溶于水,能溶于稀硝酸,可由碳酸银与醋酸反应制得,常用做分析试剂、卤素的去除、医药等。请回答下列问题:
(1)写出CH3COOAg与稀硝酸反应的离子方程式:__________________。
(2)CH3COOAg可用于去除水中的Cl-,由此可推测Ksp(CH3COOAg)____(填“>”、“<”或“=”)
Ksp(AgCl)。
(3)将足量的CH3COOAg分别加入:①100 mL蒸馏水中;②100 mL 0.1mol·L-1 CH3COONa溶液中;③100 mL0.1 mol·L-1AgNO3溶液中充分搅拌后,相同温度下,所得溶液中Ag+浓度最小的是_______(填序号)。
(4)某温度下,向100 mL饱和CH3COOAg溶液中加入23.4 g铜片(足量),发生反应2CH3COOAg+Cu=
(CH3COO)2Cu+2Ag。充分反应后得到的固体质量为23.78g,则该温度下CH3COOAg的Ksp=________。
参考答案:(1)CH3COOAg+H+=Ag++CH3COOH
(2)>
(3)②
(4)2.5×10-3
本题解析:
本题难度:一般
2、选择题 下列叙述正确的是
A.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同
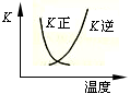
B.2SO2(g) + O2(g)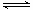 2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示
2SO3(g)的正、逆反应的平衡常数K随温度的变化可用上图表示
C.2NO+2CO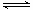 2CO2+N2的ΔH<0,常温下该反应一定能自发进行
2CO2+N2的ΔH<0,常温下该反应一定能自发进行
D.25°C时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)减小
参考答案:B
本题解析:A、醋酸抑制水的电离,氯化铵水解促进水的电离,故A错误;B、正反应为放热反应,温度升高平衡向逆反应方向移动,正反应的平衡常数减小,逆反应的平衡常数增大,故B正确;C、该反应是气体系数和减小的反应,故ΔS<0,ΔH—TΔS不一定小于0,故C错误;D、铵根离子结合氢氧化镁电离生成的氢氧根离子,使氢氧根离子的浓度减小,电离平衡向右移动,镁离子的浓度增大,故D错误;故选B。
本题难度:一般
3、填空题 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/ mol·L-1)如图所示。
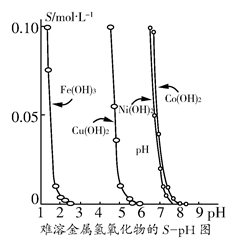
(1)pH=3时溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH________。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是__________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式:________________________。
(5)已知一些难溶物的溶度积常数如下表:
物质
| FeS
| MnS
| CuS
|
Ksp
| 6.3×10-18
| 2.5×10-13
| 1.3×10-35
|
物质
| PbS
| HgS
| ZnS
|
Ksp
| 3.4×10-28
| 6.4×10-33
| 1.6×10-24
|
?
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________。
A.NaOH B.FeS C.Na2S
参考答案:(1)Cu2+ (2)B (3)不能 Co2+和Ni2+沉淀的pH范围相差太小 (4)Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O (5)B
本题解析:由图可知,在pH=3时溶液中不会出现Cu(OH)2沉淀。
(2)要除去Fe3+的同时必须保证Cu2+不能沉淀,因此pH应保持在4左右。
(3)从图示关系可看出,Co2+和Ni2+沉淀的pH范围相差太小,不能通过调控pH而达到分离的目的。
(4)Cu(OH)2(s) Cu2+(aq)+2OH-(aq),加入氨水后生成难电离的[Cu(NH3)4]2+,促进Cu(OH)2的溶解。
Cu2+(aq)+2OH-(aq),加入氨水后生成难电离的[Cu(NH3)4]2+,促进Cu(OH)2的溶解。
(5)要使三种离子生成沉淀,最好选择难溶于水的FeS,使三种杂质离子转化为更难溶解的金属硫化物沉淀,同时又不会引入其他离子。
本题难度:一般
4、填空题 有甲、乙两同学做了如下实验:甲同学在制得的Mg(OH)2沉淀中加入浓的NH4Cl溶液,结果沉淀溶解;乙学生在制得的Mg(OH)2沉淀中加入浓的CH3COONH4溶液,结果沉淀也完全溶解。对此甲、乙两同学用学过的有关知识各自解释了上述实验事实:甲同学的解释为:因为NH4Cl溶液中,NH4++H2O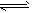 NH3·H2O+H+,且Mg(OH)2(s)
NH3·H2O+H+,且Mg(OH)2(s) Mg2++2OH-;又H++OH-=H2O,所以Mg(OH)2溶解平衡向右移动,促进
Mg2++2OH-;又H++OH-=H2O,所以Mg(OH)2溶解平衡向右移动,促进
Mg(OH)2的溶解。乙同学的解释为:因为NH4Cl=NH4++Cl-,CH3COONH4=CH3COO-+NH4+,且
Mg(OH)2(s) Mg2++2OH-;NH4++OH-=NH3·H2O,所以所以Mg(OH)2溶解平衡向右移动,促进
Mg2++2OH-;NH4++OH-=NH3·H2O,所以所以Mg(OH)2溶解平衡向右移动,促进
Mg(OH)2的溶解。你认为哪一位同学的解释是正确的?______________________________________________________________________________
参考答案:乙同学的解释是正确的。甲同学认为由NH4+的水解所提供的H+中和了由Mg(OH)2电离出来的OH-,而忽视了NH4Cl电离的NH4+也能结合OH-,且电离的NH4+浓度又远远大于由NH4+水解出来的H+浓度。由于
CH3COONH4溶液呈中性,不可能是溶液的水解产生的酸碱性影响Mg(OH)2沉淀的溶液。
本题解析:
本题难度:一般
5、选择题 下表列出了几种常见物质的电离常数或溶度积

在一定量的0.2 mol/L CaCl2溶液中加入等体积的下列溶液,可以产生沉淀的是
[? ]
A.由水电离出的c(H+) =10-9mol/L的HF溶液
B.pH=10的氨水
C.1 mol/L的NaHCO3溶液
D.10-9 mol/L的AgNO3溶液
参考答案:C
本题解析:
本题难度:一般