1、选择题 把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)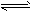 Ca2+(aq)+2OH-(aq)。当向悬浊液中加入少量生石灰后,若温度保持不变,下列判断正确的是
Ca2+(aq)+2OH-(aq)。当向悬浊液中加入少量生石灰后,若温度保持不变,下列判断正确的是
[? ]
A.溶液的pH增大
B.溶液的pH不变
C.溶液中Ca2+数目增多
D.溶液中c(Ca2+)增大
参考答案:B
本题解析:
本题难度:一般
2、填空题 (12分)实验室用氧化锌矿粉(主要含ZnO、FeCO3、CuO等)制备碱式碳酸锌[Zn2(OH)2CO3],并将其用于合成氨工艺脱硫研究。
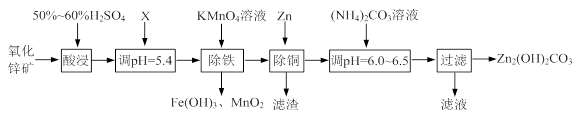
(1)“酸浸”时保持H2SO4过量的目的是 。
(2)已知:Mn2+开始沉淀的pH=8.1。
①写出加入KMnO4溶液除铁的离子方程式: 。
②流程中调节pH=5.4所加试剂X为 (填化学式);试剂X、KMnO4溶液加入顺序能否互换?请判断并说明理由 。
(3)上述流程中的“滤液”可以用作化肥,该滤液的主要成分为 (填化学式)。
(4)合成氨原料气脱硫原理如图,碱式碳酸锌吸收硫化氢的化学方程式为 。

参考答案:(1)提高矿石的浸出率(或防止Zn2+、Fe2+、Cu2+等金属离子水解)(答1点即给分)
(2)①3Fe2+ + MnO4-+7H2O=3Fe(OH)3↓ + MnO2 ↓+5H+(不配平扣1分)
②ZnO(或答碱式碳酸锌、碳酸锌、氢氧化锌、氨水等均给分)
不能,(1分)强酸性条件下KMnO4被还原成Mn2+,在除去Mn2+时,会使Zn2+同时沉淀(1分)
(3)(NH4)2SO4(多答碳酸氢铵等视而不见)
(4)Zn2(OH)2CO3 + 2H2S=2ZnS↓+CO2↑+3H2O(不配平扣1分)
本题解析:(1)“酸浸”时,硫酸与ZnO、FeCO3、CuO反应,生成硫酸盐等,溶液中存在金属阳离子,均会发生水解反应,所以酸浸时硫酸过量的目的是提高矿石的浸出率,防止Zn2+、Fe2+、Cu2+等金属离子水解;
(2)①由流程图可知,加入高锰酸钾除铁时,Fe元素以氢氧化铁的形式除去,同时生成二氧化锰,所以加入KMnO4溶液除铁的离子方程式是3Fe2+ + MnO4-+7H2O=3Fe(OH)3↓ + MnO2 ↓+5H+;
②最终的产物是碱式碳酸锌流程中调节pH=5.4所加试剂X既能除去过量的硫酸调节溶液的pH又不能引入新的杂质,所以X只能是ZnO或碱式碳酸锌、碳酸锌、氢氧化锌等;
试剂X与高锰酸钾不能互换,因为在酸性条件下,高锰酸根离子被还原为锰离子,而锰离子沉淀时的pH=8.1>5.4,此时Zn2+也会沉淀,所以不能互换;
(3)由流程图可知,除铜后的溶液中的溶质为硫酸锌,加入碳酸铵后,主要得到碱式碳酸锌和硫酸铵,硫酸铵可做化肥,所以滤液中的溶质是(NH4)2SO4;
(4)碱式碳酸锌吸收硫化氢后得到ZnS沉淀,同时又二氧化碳、水生成,过滤后可达到除硫的目的,所以碱式碳酸锌吸收硫化氢的化学方程式为Zn2(OH)2CO3 + 2H2S=2ZnS↓+CO2↑+3H2O。
考点:考查对工业流程的分析,物质性质的判断
本题难度:困难
3、选择题 下列说法中,错误的是
[? ]
①同一元素的不同核素互称为同位素?
②化学键可以使离子相结合,也可以使原子相结合
③金属腐蚀的实质是金属原子失去电子被还原的过程?
④Ksp不仅与难溶电解质的性质和温度有关,而且还与溶液中的离子浓度有关?
⑤蓄电池在放电过程中,负极质量一定减少,正极质量一定增加?
⑥Al和Fe在一定条件下都能与某些氧化物反应
⑦干冰和氨都属于弱电解质?
⑧汽油和花生油的主要成份都是油脂
A.①③④⑦⑧?
B.?③④⑤⑦⑧?
C.②③④⑤⑧?
D.①③⑤⑥⑦
参考答案:B
本题解析:
本题难度:简单
4、填空题 (1)已知可逆反应:M(g)+N(g)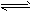 P(g)+Q(g) △H>0,请回答下列问题。
P(g)+Q(g) △H>0,请回答下列问题。
①若要增大M的转化率,在其他条件不变的情况下可以采取的措施为______(填序号)。
A.加入一定量M B.降低反应温度 C.升高反应温度
D.缩小容器体积 E.加入催化剂 F.分离出一定量P
②在某温度下起始反应物的浓度分别为:c(M)=1 mol/L,c(N)=2.4 mol/L,达到平衡后,M的转化率为
60%,此时N的转化率为_________;若保持温度不变,起始反应物的浓度改为:c(M)= 4 mol/L,c(N)=
a mol/L,达到平衡后,c(P)=2 mol/L,则a=__________mol/L。
(2)盖斯定律在生产和科学研究中有很重要的意义。试根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47.2 kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.5 kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:_____________________。
(3)一定温度下,向Na2CO3溶液中加入BaCl2和K2SO4,当两种沉淀共存时,c(CO32-):c(SO42-)=____。 [已知Ksp(BaSO4)=1.3×10-10,Ksp(BaCO3)=2.6×10-9]
参考答案:(1)①CF;②25%;6
(2)CO(g)+FeO(s)=Fe(s)+CO2(g) △H=-218.0kJ/mol
(3)20
本题解析:
本题难度:一般
5、选择题 下列有关溶度积常数Ksp的说法正确的是
A.常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小
B.溶度积常数Ksp只受温度影响,温度升高Ksp减小
C.溶度积常数Ksp只受温度影响,温度升高Ksp增大
D.常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变
参考答案:D
本题解析:Ksp像其它常数一样,只与温度有关,对大多数难溶解电解质来说,温度升高,平衡向正向移动,Ksp增大,但也有减少的,A、B、C都错;答案选D。
本题难度:一般