1、实验题 (16分)过氧化钙(CaO2)常用作种子消毒剂、药物制造、 油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体
油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体 生成。有人提出:CO2、SO2与过氧化
生成。有人提出:CO2、SO2与过氧化 钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断
钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断 。
。
实验一、通过气体体积的测量判断发生的化学反应,实验装置如下:
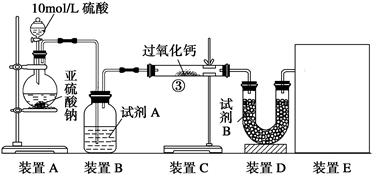
(1)试剂A可以选用?,试剂B为碱石灰其作用是______________________。
(2)装置E用于测定氧气 的体积
的体积 ,请在框中画出装置图。
,请在框中画出装置图。
(3)实验测得装 置C增重m1 g,装置D增重m2 g,装置E中收集到V L气体(已换算成标准状况下),用上述有关测量数据判断,当SO2未氧化时,V与m1或m2的关系式为_________。
置C增重m1 g,装置D增重m2 g,装置E中收集到V L气体(已换算成标准状况下),用上述有关测量数据判断,当SO2未氧化时,V与m1或m2的关系式为_________。
若SO2完全氧化,写出反应的化学方程式:___________________________________。
实验二、向一定量的过氧化钠固体中通入足量SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
提出假设:
假设1:反应后固体中只有Na2SO3,SO2未氧化;
假设2:反应后固体中只有Na2SO4,SO2完全氧化;
假设3 :________________________________________________________________。
:________________________________________________________________。
实验探究:
(4)设计实验证明假设3是正确的,简要回答实验过程、现象和结论:________________
____________________________________________________________________________。
实 验评价:
验评价:
(5)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因:
____________________________________________________________________________。
参考答案:(16分)(1)浓硫酸 ?吸收未反应的SO2
(2)
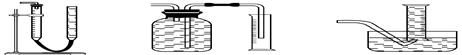
(其它合理答案均可)
(3) V=7m1/30 CaO2+SO2===CaSO4
反应后固体为Na2SO3、Na2SO4的混合物,SO2部分氧化
(4)取少量反应后的固体放入试管中,加适量水溶解,加入BaCl2溶液有白色沉淀产生。再加入稀盐酸,沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,即Na2O2将SO2部分氧化。
(5)若Na2O2剩余,固体加水溶解,过氧化钠能将SO氧化成SO。
本题解析:(1)试剂A可用浓硫酸,用于SO2的干燥,试剂B为碱石灰其作用是吸收未反应的SO2;
(2)测CaO2与SO2反应生成的氧气的体积,可用如右装置:
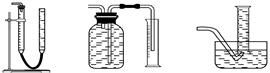
(3)当SO2未氧化时,发生的反应为
2CaO2+2SO2=2CaSO3+O2?m
2x72? 2x120? 22.4L? 96
VL? m1?22.4/V="96/" m1? V=7m1/30
SO2完全氧化,化学方程式为CaO2+SO2===CaSO4
假设3:反应后固体为Na2SO3、Na2SO4的混合物,SO2部分氧化
(4)探究假设3是否正确,主要检验混合物中是否含Na2SO3及Na2SO4,即设计实验证明Na2SO3、Na2SO4的存在,可取少量反应后的固体放入试管中,加适量水溶解,加入BaCl2溶液有白色沉淀产生,再加入稀盐酸,沉淀部分溶解,证明原固体中既有亚硫酸钠也有硫酸钠,则Na2O2将SO2部分氧化。(5)由于过氧化钠能将SO氧化成SO,则不能确定过氧化钠与SO2是否生成了Na2SO3、Na2SO4的混合物,所以通入的SO2应足量,使过氧化钠无剩余。
本题难度:一般
2、实验题 (5分)某化学学习小组用如图所示装置研究不同条件下铁与硝酸反应的情况。其实验步骤如下:
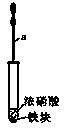
①在大试管中先加入一小块铁(过量),再加入一定量的浓硝酸;
②用仪器a再加入适量的水;
③反应结束后取少量上层溶液于另一试管中,滴加几滴KSCN溶液;
④再用仪器a向③的试管中滴加适量的稀盐酸。
请回答下列问题:
(1)仪器a的名称是?
(2)步骤①无明显现象,原因是?
(3)步骤④的主要现象是?
(4)学习小组在进行实验后发现该实验装置存在着一明显的缺陷,请给出一种简单的消除此缺陷的措施?。
参考答案:(1)(胶头)滴管(1分)
(2)常温下铁在浓硝酸中钝化(1分)
(3)有无色气体放出,在试管口变为红棕色,溶液变成血红色(2分)
(4)管口塞蘸有碱液的棉花团(1分)
本题解析:略
本题难度:简单
3、选择题 下列实验操作都可能引起实验误差,其中说法正确的是( )
A.常温下测定的气体摩尔体积大于22.4 L·mol-1
B.100 mL 0.1 mol·L-1NaOH溶液和100 mL 0.1mol·L-1CH3COOH溶液反应放出的热量等于573 J
C.配制1.0 mol·L-1NaCl溶液定容时仰视容量瓶的刻度线导致所配溶液浓度偏高
D.中和滴定时,锥形瓶含有水就注入待测液,所测待测液浓度减小
参考答案:A
本题解析:选项A,常温下的温度大于0 ℃,在压强和气体的物质的量一定时,温度越高测出的体积越大。选项B,CH3COOH是弱酸,电离需要吸热,测出的值应小于573 J。选项C,定容时仰视容量瓶的刻度线时,所加水的量增大,导致所配溶液浓度偏低。选项D,锥形瓶中是否有水对测定结果没有影响,因此答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。
该题的关键是明确实验原理,然后结合题意灵活运用即可。
本题难度:简单
4、实验题 某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现黑色和红色交替的现象,请写出相应的化学方程式 ??、??。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是?反应。(填吸热或放热)
(2)甲和乙两个水浴作用不相同.甲的作用是?;乙的作用是 ?。
(3)反应进行一段时间后,试管a中收集到的主要有机生成物是?。(写名称)若要检验试管a中能收集的该物质,进行的操作为 ??。?
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有 ??。(写结构简式)
要除去该物质,可向混合液中加入 ?(填写序号)。再通过?(填试验操作名称)即可除去。
A.水
B.苯
C.碳酸氢钠溶液
D.四氯化碳
参考答案:(1)Cu+O2 2CuO、CH3CH2OH+CuO
2CuO、CH3CH2OH+CuO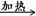 CH3CHO+Cu+H2O;放热;
CH3CHO+Cu+H2O;放热;
(2)加热乙醇,便于乙醇的挥发;冷却,便于乙醛的收集;(3)乙醛;加入新制的氢氧化铜悬浊液,加热煮沸若有砖红色沉淀,证明产物是乙醛;(4)CH3COOH;C;蒸馏。
本题解析:(1)在加热Cu丝时发生反应Cu+O2 2CuO。当把热的Cu丝遇到乙醇蒸气时发生反应:CH3CH2OH+CuO
2CuO。当把热的Cu丝遇到乙醇蒸气时发生反应:CH3CH2OH+CuO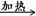 CH3CHO+Cu+H2O。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是放热反应,反应放出的热量就足够后面发生反应需要消耗的能量。(2)甲的水浴加热作用是产生乙醇蒸气,便于乙醇的挥发;而乙用的是冷水浴。目的是冷却降温,便于乙醛的收集。(3)由(1)的反应方程式可知:反应进行一段时间后,试管a中收集到的主要有机生成物是乙醛。若要检验试管a中能收集的该物质,可以利用醛基的性质进行的操作是加入新制的氢氧化铜悬浊液,加热煮沸若有砖红色沉淀产生,证明产物是乙醛;(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有酸性物质。在该该反应中产生来源:91考试网的酸性物质只有乙酸CH3COOH。为除去乙酸。可以利用乙酸不同与乙醛的性质:有酸性,而且酸性比碳酸强,乙酸能跟碳酸盐发生反应消耗,同时生成的碳酸不温度,会分解,以气体的形式扩散。从而达到除杂的目的。反应的方程式为:NaHCO3+CH3COOH→CH3COONa+H2O+ CO2↑。选项为C。反应后的溶液为CH3COONa和乙醛的混合溶液。乙酸钠是离子化合物,熔沸点高,而乙醛的沸点较低,所以再通过蒸馏就可以除去乙酸钠,得到纯净的乙醛。
CH3CHO+Cu+H2O。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是放热反应,反应放出的热量就足够后面发生反应需要消耗的能量。(2)甲的水浴加热作用是产生乙醇蒸气,便于乙醇的挥发;而乙用的是冷水浴。目的是冷却降温,便于乙醛的收集。(3)由(1)的反应方程式可知:反应进行一段时间后,试管a中收集到的主要有机生成物是乙醛。若要检验试管a中能收集的该物质,可以利用醛基的性质进行的操作是加入新制的氢氧化铜悬浊液,加热煮沸若有砖红色沉淀产生,证明产物是乙醛;(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有酸性物质。在该该反应中产生来源:91考试网的酸性物质只有乙酸CH3COOH。为除去乙酸。可以利用乙酸不同与乙醛的性质:有酸性,而且酸性比碳酸强,乙酸能跟碳酸盐发生反应消耗,同时生成的碳酸不温度,会分解,以气体的形式扩散。从而达到除杂的目的。反应的方程式为:NaHCO3+CH3COOH→CH3COONa+H2O+ CO2↑。选项为C。反应后的溶液为CH3COONa和乙醛的混合溶液。乙酸钠是离子化合物,熔沸点高,而乙醛的沸点较低,所以再通过蒸馏就可以除去乙酸钠,得到纯净的乙醛。
本题难度:一般
5、实验题 (14分)Br2和Fe3+ 的水溶液浓度较小时均呈现黄色,二者都具有较强的氧化性。某化学兴趣小组拟通过探究实验来比较二者氧化性的强弱。
实验操作:向足量的硫酸亚铁溶液中加入少量浓溴水,振荡。
实验现象:溶液由浅绿色变为黄色。
(1)提出假设:
甲同学认为氧化性:Br2 >Fe3+ ,则反应的离子方程式为?;
乙同学认为氧化性:Fe3+ >Br2 ,则使溶液呈黄色的物质是?(填化学式)。
(2)通过进一步实验可以检验甲和乙的结论谁对谁错,下列是设计的一些实验方案和预测:
方案
| 实验操作
| 预期现象及结论
|
1
| 取少量黄色溶液,加入NaOH溶液
| 若生成红褐色沉淀,则甲正确
|
2
| 取少量黄色溶液,加入淀粉KI溶液
| 若溶液变蓝色,则乙正确
|
3
| 取少量黄色溶液,加入苯溶液,振荡后静置
| 若上层溶液呈橙红色,则?正确?
|
①方案1是否合理?(填“是”或“否”)。
②方案2中,由于存在反应 ?(用离子方程式表示),
?(用离子方程式表示),
所以预测结论不正确。
③请另外设计一个合理方案,证明已经发生反应。将有关内容填入下表。
实验操作
| 预期现象及结论
|
?
| ?
参考答案:(14分)(1)Br2 + 2Fe2+  ?2Br-+ 2Fe3+(2分);? Br2(2分)。 ?2Br-+ 2Fe3+(2分);? Br2(2分)。
(2)乙(2分)?①否(2分)?② 2Fe3+ + 2I- ?I2 + 2Fe2+ (2分) ?I2 + 2Fe2+ (2分)
③请另外设计一个合理方案,证明已经发生反应。(以下每空2分)
实验操作
预期现象及结论
取少量黄色溶液,滴入几滴KSCN溶液
若溶液变红色,则证明已经发生反应
本题解析:略
本题难度:一般
|