1、实验题 (15分)资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物。某同学通过如下实验探究反应原理并验证产物。
实验I:用砂纸擦去镁条表面氧化膜,将其放入盛适量滴有酚酞的饱和碳酸氢钠溶液的烧杯中,迅速反应,产生大量气泡和白色不溶物,溶液的浅红色加深。
(1)该同学对反应中产生的白色不溶物做出如下猜测:
猜测1:白色不溶物可能为 ??
猜测2:白色不溶物可能为MgCO3
猜测3:白色不溶物可能为碱式碳酸镁[xMg(OH)2?yMgCO3]
(2)为了确定产物成份(包括产生的气体、白色不溶物及溶液中溶质),进行以下定性实验。请填写表中空白:
实验序号
| 实?验
| 实验现象
| 结?论
|
实验Ⅱ
| 将实验I中收集到的气体点燃
| 安静燃烧,火焰呈淡蓝色
| 气体成分为 ?①?
|
实验Ⅲ
| 将实验I中的白色不溶物滤出、洗涤,取少量加入足量?②?
| ?
?③?
| 白色不溶物中含有MgCO3
|
实验Ⅳ
| 取实验Ⅲ中的滤液,向其中加入适
量 ④ ?稀溶液
| 产生白色沉淀,溶液红色变浅
| 溶液中存在CO32-离子
|
(3)为进一步确定实验I中白色不溶物的成分,进行以下定量实验,装置如图所示:
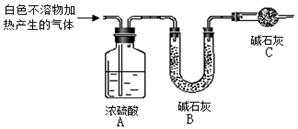
称取干燥、纯净的白色不溶物 4.52 g,充分加热至不再产生气体为止,并使分解产生的气体全部进入装置A和B中。实验后装置A增重0.36 g,装置B增重1.76 g。
①装置C的作用是??;
②白色不溶物的化学式为 ?。
(4)根据以上(2)及(3)的定性定量实验,写出镁与饱和碳酸氢钠溶液反应的化学方程式
__________________________________________________________________________。
参考答案:(1)猜测1: Mg(OH)2(2分)
(2)①氢气(或H2)(1分) ?
②稀盐酸(合理均可)(2分)
③产生气泡,沉淀全部溶解 (2分)?
④CaCl2或BaCl2(2分)
(3)①防止空气中的水蒸气和CO2进入装置B中,影响实验结果(2分)
②Mg(OH)2?2MgCO3 或 Mg3(OH)2(CO3)2 (2分)
(4)3Mg+4NaHCO3+2H2O= Mg(OH)2? 2MgCO3↓+2Na2CO3+3H2↑(2分)
本题解析:⑴根据猜测2、3的内容可确定猜测1为“白色不溶物可能为Mg(OH)2”;
⑵实验Ⅱ:根据气体的火焰呈淡蓝色,可确定气体的成分为氢气;
实验Ⅲ:结合Mg(OH)2、MgCO3的性质,可用稀盐酸等与其反应,若产生气泡,且沉淀全部溶解,说明白色不溶物中含有MgCO3;
实验Ⅳ:要证明溶液中存在CO32-离子,可向实验Ⅲ的滤液中加入CaCl2或BaCl2,观察是否产生白色沉淀来证明;
⑶①装置末端用碱石灰吸收空气中水蒸气和CO2,防止其进入装置B中,影响实验结果;
②根据xMg(OH)2?yMgCO3的灼烧反应:xMg(OH)2?yMgCO3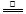 (x+y)MgO+xH2O+yCO2
(x+y)MgO+xH2O+yCO2
有n(H2O)=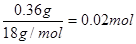 ;n(CO2)=
;n(CO2)=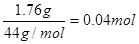 ,则x:y=1:2,即得白色不溶物的化学式为Mg(OH)2?2MgCO3或Mg3(OH)2(CO3)2。
,则x:y=1:2,即得白色不溶物的化学式为Mg(OH)2?2MgCO3或Mg3(OH)2(CO3)2。
⑷综上可得该反应的反应物有Mg、NaHCO3,生成物有Mg(OH)2? 2MgCO3、Na2CO3、H2,最后根据观察法将其配平。
本题难度:一般
2、简答题 某小组为证明同温同压下,同浓度,同体积的酸性不同的两种二元酸与足量镁带反应时生成H2量相同而反应速率不同,装置如图.主要步骤如下:
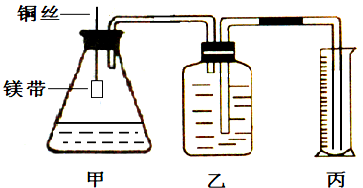
(1)配制浓度为0.5mol/L的硫酸和草酸溶液;
(2)用______量取10.00mL0.5mol/L的硫酸和草酸溶液分别加入两锥形瓶中;
(3)分别取去表面氧化膜的鎂带系于铜丝末端;
(4)检查装置气密性,乙中装满水,按图连接好装置;
(5)将铜丝下移,使足量鎂带浸如酸中(铜丝不与酸接触)至完全反应,同时记录______;
(6)反应结束时,读取量筒内水体积ymL.
将以上步骤补充完整并回答下列问题
(1)(4)中如何检查气密性______;
(2)用ρ=1.84?98.3%的浓硫酸配制250mL,c=0.5mol/L硫酸,主要仪器有______、______、烧杯、玻璃棒、酸式滴定管等;
(3)读取量筒内水体积时,必须注意的问题是______;
(4)简述速率不等的原因______,铜丝不能与酸接触的原因______;
(5)此实验说明草酸为弱酸,请再设计一实验证明:______.
参考答案:酸溶液应用酸式滴定管量取,如用碱式滴定管会腐蚀橡胶管;比较化学反应速率,必须是比较一定时间之内的反应物浓度的变化或其它量的变化,故答案为:酸式滴定管;反应所需时间;
(1)如不漏气,加热时容器内压强增大,会有气泡冒出,故答案为:往丙中加水没过导气管口下端,两手掌紧贴甲外壁一会儿,若观察到丙中导气管冒气泡,表明装置不漏气;
(2)配制溶液所需仪器有:250ml容量瓶、烧杯、玻璃棒、量筒或滴定管、胶头滴管等.故答案为:250ml容量瓶、胶头滴管;
(3)读数时要保持左右气体压强相等,以减少误差,故答案为:读数时保持乙丙中液面相平;待装置冷却至室温再读数;
(4)影响化学反应速率的因素有浓度、温度、压强等,本题为浓度不同,为测定镁与酸反应的速率,不能将铜丝与酸接触,否则易形成原电池,加快反应速率,干扰实验测定,
故答案为:H+浓度不同;与铜易形成原电池,加快反应速率,干扰实验测定;
(5)弱电解质存在电离平衡、不完全电离等性质,可任意选择合理方法,故答案为:测定草酸钠溶液的PH,如大于7,则为弱酸(其它合理答案也可以).
本题解析:
本题难度:一般
3、实验题 (5分)某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。
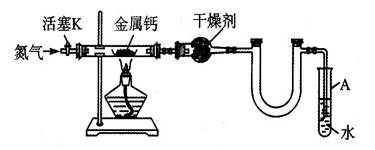
(1)按图连接好实验装置,检查装置的气密性的方法是 。
(2)反应过程中末端导管必须始终插入试管A的水中,目的是 。
(3)制备氮化钙的操作步骤是①打开活塞K并通入N2;②点燃酒精灯,进行反应;
③反应结束后, ;④拆除装置,取出产物。
(4)数据记录如下:
直玻管质量m0/g
| 直玻管与钙的质量m1/g
| 直玻管与产物的质量m2/g
|
14.80
| 15.08
| 15.15
|
①计算得到实验式CaxN2,其中x= 。
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:
。
参考答案:(5分)
(1)关闭活塞K,加热直玻管,若导管口处产生气泡,停止加热后,导管中形成一段液柱,则气密性良好。
(2)防止反应过程中空气进入反应管,便于观察N2流速
(3)熄灭酒精灯,待反应管冷却至室温,停止通N2,并关闭活塞K
(4)①2.80
②x<3 O2和N2与等质量的Ca反应,生成CaO质量高于Ca3N2,导致计算出的n(N)偏大
本题解析:由于金属钙为特别活泼的金属,故在制取Ca3N2的过程中,必须保证系统中无其它杂质气体,保证气密性良好:实验前先通入氮气,再加热,实验结束时,先停止加热、冷却后再停止通氮气
(2)防止空气从装置右端进入装置内,并且通过观察气泡来控制气体流速
(4)①由所给数据可知钙的质量为:15.08-14.80=0.28g,氮元素的质量为:15.15-15.08=0.07g,则两元素的原子个数比为: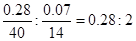 ,故x=0.28
,故x=0.28
②O2和N2与等质量的Ca反应,生成CaO质量高于Ca3N2,导致计算出的n(N)偏大,故x<3(或采用极值法来考虑:当气体全部为氧气时,得到的物质为CaO(即Ca2O2),而全部为氮气时得到的为Ca3N2,故通入的N2中混有少量O2时,所得物质的分子式中x<3)
本题难度:一般
4、填空题 有一种由CO、CO2、H2、水蒸气四种气体组成的混合气体,要证明其中含有CO和 H2,可选用的仪器及药品如下:
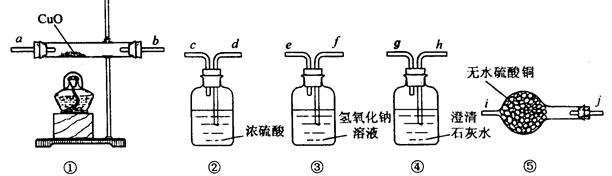
 (1)实验时,导管接口的顺序是?。
(1)实验时,导管接口的顺序是?。
(2)装置①内发生反应的化学方程式是?(任写一个,并标出电子转移方向和数目)。
(3)证明混合气体中含有氢气的实验现象是? ?。(4)证明混合气体中含有CO的实验现象是?。
?。(4)证明混合气体中含有CO的实验现象是?。
参考答案:⑴? f e d c a b? j i h g? ⑵ CO + CuO ═ Cu + CO2 ?或 H2 + CuO ═ Cu + H2O
⑶ ⑤中的无水硫酸铜变蓝(4)④中出现浑浊
本题解析:略
本题难度:简单
5、选择题 草酸晶体(H2C2O4·2H2O)? 100℃开始失水,101.5℃熔化,150℃左右分解产生H2O、CO和CO2。用加热草酸晶体的方法获取某些气体,应该选择的气体发生装置是(图中加热装置已略去)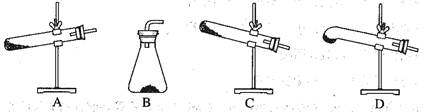
参考答案:D
本题解析:草酸晶体受热时会熔化,同时反应中生成水蒸气,为避免液体回流,装置只能选择D。答案选D。
本题难度:一般