1、填空题 (8分)在一体积为1 L的容器中,通入一定量的N2 O4,在100℃时发生如下反应:

(1)在0-60s这段时间内,以N2O4表示的平均反应速率为?mol·L-1·s-1
(2)上述反应的平衡常数表达式为?,升高温度K值??(填“增大"、“减小”或“不变”)
(3)反应进行到100s时,若有一项条件发生变化,变化的条件不可能是??(填选项序号)。
A.降低温度
B.通人氦气使其压强增大
C.又往容器中充入N2O4
D.使用催化剂
参考答案:(1)0.001
(2)K=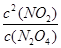 ?增大
?增大
(3)BCD
本题解析:(1)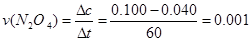 ?mol·L-1·s-1
?mol·L-1·s-1
(2)由平衡常数的概念可知:K=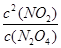 ;由于△H>0,升温平衡正向移动,K增大
;由于△H>0,升温平衡正向移动,K增大
(3)由图像可知,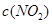 逐渐减小,而
逐渐减小,而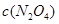 逐渐增大,平衡左移,故:
逐渐增大,平衡左移,故:
A:降温平衡左移,与图像相符
B:恒容下通入氩气,各物质浓度不变,正逆反应速度不变,平衡不发生移动,与图像不符
C:又往容器中充入N2O4,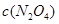 瞬间增大,与图像不符
瞬间增大,与图像不符
D:使用催化剂,不影响平衡移动,各物质浓度不变,与图像不符
故BCD符合题意
本题难度:一般
2、选择题 四位同学同时进行反应:A(g)+3B(g)=2C(g)+2D(g)的速率测定实验,分别测得反应速率如下:①v(A)=0.15mol/(L.s)?②v(B)="0.6mol/(L.s)" ③v(C)="0.4mol/(L.s)" ④v(D)= 0.45mol/(L-s)。其中,反应进行得最快的是(? )
A.①?B.②? C.③?D.④
参考答案:D
本题解析:利用不同物质表示的速率与化学计量数的比值,求出该反应的化学反应速率,然后进行比较。①v(A)=0.15mol/(L?s),A的化学计量数为1,v=0.15mol/(L?s);②v(B)=0.6mol/(L?s),B的化学计量数为3,v=0.2mol/(L?s);③v(C)=0.4mol/(L?s),C的化学计量数为2,v=0.2mol/(L?s);④v(D)=0.45mol/(L?s),D的化学计量数为2,v=0.225mol/(L?s);速率由快到慢顺序为:④>②=③>①,选D。
本题难度:一般
3、选择题 加入正催化剂使反应速率加快,下列叙述不正确的是( )
A.使反应体系的活化能降低
B.使反应体系的活化分子总数增多
C.使正反应速率增大,逆反应速率减小
D.使反应体系的活化分子百分数增大
参考答案:A、加入正催化剂使反应体系的活化能降低,进而使反应速率加快,故A正确;
B、正催化剂使反应体系的活化分子总数增多,故B正确;
C、催化剂能同等程度的改变正逆反应速率,加入正催化剂使正反应速率增大,逆反应速率也增大,故C错误;
D、催化剂可以使反应体系的活化分子百分数增加,故D正确.
故选C.
本题解析:
本题难度:一般
4、选择题 实验室用Zn与稀硫酸反应来制取氢气,常加入少量CuSO4来加快反应的速率。为了研究 CuSO4的量对生成H2速率的影响,某同学设计了如下实验方案(见下表),将表中所给的试剂按一定体积混合后,分别加入四个盛有相同大小的Zn片(过量)的反应瓶(甲、乙、丙、丁)中,收集产生的气体,并记录收集相同体积的气体所需的时间。下列说法正确的是?
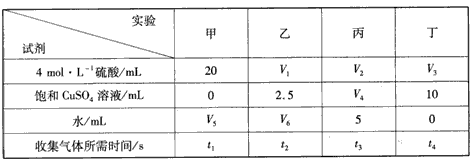
[? ]
A. t1=t2=t3=t4
B. V4=V5 =10 mL
C. V6 =7.5 mL
D. V1<V2<V3 <20mL
参考答案:C
本题解析:
本题难度:一般
5、选择题 在2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.4kJ?mol-1.起始反应时NO和CO各为4mol,10秒钟后达到化学平衡,测得N2为1mol.下列有关反应速率的说法中,正确的是( )
A.反应前5秒钟内,用NO表示的平均反应速率为0.1mol?L-1?s-1
B.达到平衡后,升高温度,正反应速率将减小,逆反应速率将增大
C.达到平衡后,反应速率的关系有:v正(CO)=2v逆(N2)
D.保持容器体积不变,往容器中充入1mol?O2,正、逆反应速率都不改变
参考答案:A、前10秒钟内,v(N2)=1mol2L10s=0.05mol/(L?s),速率之比等于化学计量数之比,故前10s内v(NO)=2v(N2)=2×0.05mol/(L?s)=0.1mol/(L?s),前5s反应物的浓度更大,反应速率更快,故前5s的平均速率大于前10s的平均速率,即前5秒钟内,用NO表示的平均反应速率大于0.1mol/(L?s),故A错误;
B、升高温度正、逆反应速率都增大,故B错误;
C、可逆反应达平衡时,用不同物质表示正、逆速率之比等于化学计量数之比,v正(CO)=2v逆(N2)时正、逆速率之比等于化学计量数之比,说明反应到达平衡状态,故C正确;
D、NO与氧气反应,NO浓度降低,瞬间反应物的浓度降低,正反应速率降低,故D错误;
故选C.
本题解析:
本题难度:一般