| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《化学反应速率》考点强化练习(2019年押题版)(四)
参考答案:A 本题解析:可逆反应: 2 A(g) +B(g) 本题难度:一般 2、填空题 某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5
根据表中数据判断试样的pH= 。 (2)为减少SO2的排放,常采取的措施有: ①将煤转化为清洁气体燃料。 已知:H2(g)+1/2O2(g)=H2O(g) △H=-241.8kJ·mol-1 C(s)+1/2O2(g)="CO" (g) △H=-110.5kJ·mol-1 写出焦炭与水蒸气反应的热化学方程式: 。 ②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。 A.Ca(OH) 2 B.Na2CO3 C.CaCl2D.NaHSO3 (3)汽车尾气中有NOx和CO的生成及转化 ① 若1mol空气含0.8molN2和0.2molO2,汽缸中的化学反应式为N2 (g)+O2(g) 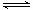 2NO(g) △H 2NO(g) △H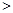 0 01300℃时将1mol空气放在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。 汽车启动后,汽缸温度越高,单位时间内NO排放量越大,其原因是 。 ②目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。 ③ 汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g) 已知该反应的△H 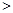 0,判断该设想能否实现并简述其依据: 。 0,判断该设想能否实现并简述其依据: 。 参考答案:(1)PH=4 本题解析: (1)根据溶液呈电中性的原理可得c(H+)+c(K+)+c(Na+)+c(NH4+)=2c(SO42-)+c(NO3-)+c(Cl-)。将各个数值代入上述式子可得c(H+)=1.0×10-4mol/L,所以pH=4;(2)① ②-①整理可得C(s)+H2O(g)=H2(g)+CO(g) △H=+131.3kJ/mol;②A.Ca(OH) 2+ SO2=CaSO3↓+H2O;正确。B.Na2CO3+ SO2=Na2SO3+ CO2。正确。C.CaCl2不反应,不能作吸收剂,错误。D.NaHSO3不反应,不能作吸收剂,错误。(3)①在反应开始时,n(N2)=0.8mol;n(O2)=0.2mol;n(NO)=0;当反应达到平衡时,n(N2)=(0.8-4×10-4)mol 本题难度:困难 3、选择题 700℃时,向容积为1 L的密闭容器中充入一定量的CO2和H2,发生反应:
A.反应在t1 min内的平均速率为v(H2O)=0.60 /t1?mol·L-1·min-1 B.温度升至800℃,上述反应平衡常数为1.56,则正反应为放热反应 C.保持其他条件不变,向平衡体系中再通入1.00 molH2,与原平衡相比,达到新平时CO2转化率增大,H2的体积分数增大 D.保持其他条件不变,起始时向容器中充入1.00 molCO和1.50 molH2O,到达平衡时,c(CO2)=0.90 mol/L 参考答案:BD 本题解析:A、反应在t1 min内,氢气的物质的量减少0.6mol,则水蒸气的物质的量增加0.6mol,浓度增加0.6mol/L,所以t1 min内平均速率为v(H2O)=0.6mol/L/t1 min="0.60" /t1?mol·L-1·min-1,正确;B、由表中所给数据可计算t1 min时n(CO2)=0.9mol,与t2min时的n(CO2)相等,说明t1 min时反应已达平衡状态,计算该温度下的化学平衡常数K=1,而800℃,上述反应平衡常数为1.56,升高温度,平衡常数增大,说明升高温度,平衡正向移动,正向是吸热反应,错误;C、保持其他条件不变,向平衡体系中再通入1.00 molH2,则会增大CO2转化率,而本身的转化率降低,H2的体积分数增大 ,正确;D、保持其他条件不变,起始时向容器中充入1.00 molCO和1.50 molH2O,反应从逆反应开始,因为该反应的平衡常数为1,可计算达平衡时CO转化的浓度是0.6mol/L,所以到达平衡时,c(CO2)=0.60 mol/L,错误,答案选BD。 本题难度:一般 4、选择题 下列措施中,能减慢化学反应速率的是 参考答案:D 本题解析:A:利用催化剂加快反应速率 本题难度:一般 5、填空题 (6分)对于反应2S02+02
参考答案: 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《氧化性和还.. | |