1、选择题 下列各组中两个变化所发生的反应,属于同一类型的是
①由甲苯制甲基环己烷、由乙烷制溴乙烷②乙烯使溴水褪色、乙炔使酸性高锰酸钾溶液褪色③由乙烯制聚乙烯、由2-甲基-1,3-丁二烯制天然橡胶;④由苯制硝基苯、由乙烷制硝基乙烷。
A.只有②③
B.只有③④
C.只有①③
D.只有①④
2、选择题 不能用排水法收集的气体是(? )
A.H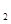
B.O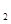
C.NO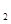
D.NO
3、实验题 Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化。为了验证该结论,学生设计了如下图所示的实验装置进行实验(夹持装置略去)。圆底烧瓶A中的反应方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,请回答下列问题
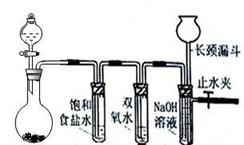
A?B ?C?D
(1)试管B中饱和食盐水的作用?;
(2)试管C中加入5mL 30% 双氧水,发生反应的化学方程式____________________;
(3)试管D中充满10% NaOH溶液,NaOH溶液的作用是?;
(4)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭止水夹,反应一段时间后试管D中的现象为?,试管D中的气体检验方法为__________________;
(5)有的同学对上述实验中试管D中气体来源产生质疑,你认为可能的来源有?(用化学方程式表示),对于质疑可以采用对比实验来解决。
4、实验题 无水氯化亚铁用于制造铁系催化剂、印染的媒染剂和染料还原剂,还可用于冶金、医药、照相等行业。一实验小组模仿工业方法制取氯化亚铁,设计装置如下
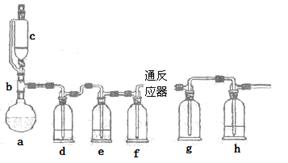
通过查阅相关资料可知:
①在持续高温500℃时,铁与纯净、干燥Cl2反应可生成FeCl2,在温度较低时可生成FeCl3;
②FeCl3熔沸点低,易升华。
根据以上信息回答相关的问题
(1)abc仪器组合成制取氯气的装置,反应无需加热,请写出a容器内所发生的化学反应方程式?。
(2)d、e盛装的药品分别是?和?,f、g的作用是?。
(3)反应器为硬质玻璃管,纯净铁粉与氯气在500℃左右反应。
①化学反应方程式为?
②实验操作顺序是:组装仪器、?、装入药品、?、?、停止加热、关闭c的活塞。
(4)实验小组记录的实验现象如下:
?
| 观察到的部分现象
|
第一次实验
| 反应器中有白雾、红色固体、g瓶有白雾和黄绿色气体
|
第二次实验
| 反应器中有绿色晶体,g瓶有红棕色的烟和黄绿色气体
|
第三次实验
| 反应器中有绿色晶体,g瓶有黄绿色气体
|
?
①第一次实验,发现e瓶没有盛装任何药品,所以得到红色固体,其原因是?。
②第二次实验,g瓶有红棕色的烟,其原因是?。
(5)第三次实验得到的固体,最可能含有微量杂质是?,如果需要配制约2~3mol/L的染料还原剂溶液,则无需除去,理由是?。
5、填空题 (15分)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂和生产含氟牙膏等。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵: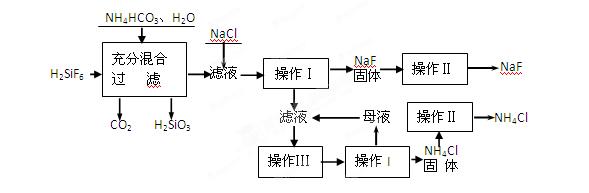
有关物质在水中溶解度(g/100gH2O)如下:
温度
| 10℃
| 20℃
| 30℃
| 溶解度:20℃NaF—4? 0℃NH4F—100;
常温Na2SiF6微溶于水
|
NH4Cl溶解度
| 33 .3 .3
| 37.2
| 41.4
|
?
请回答下列问题:
(1)操作Ⅰ需要用到的玻璃仪器有?。
(2)上述流程中发生两步反应,化学方程式为:
? ?
? ?
?
(3)操作II的作用是? ?
操作Ⅲ的具体过程是?
(4)流程中NH4HCO3必须过量,其原因是? ?
_______________________________________________________________________