1、选择题 下列各组中两个变化所发生的反应,属于同一类型的是
①由甲苯制甲基环己烷、由乙烷制溴乙烷②乙烯使溴水褪色、乙炔使酸性高锰酸钾溶液褪色③由乙烯制聚乙烯、由2-甲基-1,3-丁二烯制天然橡胶;④由苯制硝基苯、由乙烷制硝基乙烷。
A.只有②③
B.只有③④
C.只有①③
D.只有①④
参考答案:B
本题解析:略
本题难度:简单
2、选择题 不能用排水法收集的气体是(? )
A.H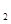
B.O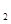
C.NO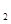
D.NO
参考答案:C
本题解析:3NO2+H2O=HNO3+NO,故NO2不能用排水法收集;由于NO2的密度比空气大,所以只能用向上排空气法来收集。其它选项的气体都不能溶解于水,也不能和水反应反应,所以都可以用排水法收集,也可以用排空气法收集。选项为C.
本题难度:一般
3、实验题 Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化。为了验证该结论,学生设计了如下图所示的实验装置进行实验(夹持装置略去)。圆底烧瓶A中的反应方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,请回答下列问题
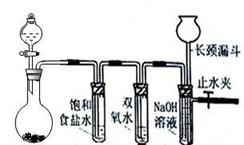
A?B ?C?D
(1)试管B中饱和食盐水的作用?;
(2)试管C中加入5mL 30% 双氧水,发生反应的化学方程式____________________;
(3)试管D中充满10% NaOH溶液,NaOH溶液的作用是?;
(4)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭止水夹,反应一段时间后试管D中的现象为?,试管D中的气体检验方法为__________________;
(5)有的同学对上述实验中试管D中气体来源产生质疑,你认为可能的来源有?(用化学方程式表示),对于质疑可以采用对比实验来解决。
参考答案:(1)除去Cl2中混有的HCl;(2)Cl2+H2O2=2HCl+O2;(3)吸收多余的Cl2;(4)试管D中液面下降,长颈漏斗中液面上升;该气体能使带火星的木条复燃,证明是氧气;(5)2H2O2=2H2O+O2↑;Cl2+H2O="HCl+HClO" ;2HClO=2HCl+O2↑。
本题解析:(1)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl-+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,故饱和食盐水的作用是除去Cl2中混有的HCl;(2)Cl2氧化能力强于H2O2,能将H2O2氧化产生O2,化学方程式Cl2+H2O2=2HCl+O2(3)有少量的Cl2没有发生反应排出,用NaOH溶液吸收多余的Cl2(4)将浓盐酸注入圆底烧瓶后产生大量的氯气,后与双氧水反应生成大量的氧气,D中装置中空气排今后止水夹关闭,D装置内压强增大使液面下降,长颈漏斗中液面上升;检验氧气的方法,使带火星的木条复燃(5)2H2O2=2H2O+O2↑;Cl2+H2O=HCl+HClO,2HClO=2HCl+O2↑。
本题难度:一般
4、实验题 无水氯化亚铁用于制造铁系催化剂、印染的媒染剂和染料还原剂,还可用于冶金、医药、照相等行业。一实验小组模仿工业方法制取氯化亚铁,设计装置如下
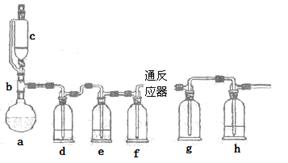
通过查阅相关资料可知:
①在持续高温500℃时,铁与纯净、干燥Cl2反应可生成FeCl2,在温度较低时可生成FeCl3;
②FeCl3熔沸点低,易升华。
根据以上信息回答相关的问题
(1)abc仪器组合成制取氯气的装置,反应无需加热,请写出a容器内所发生的化学反应方程式?。
(2)d、e盛装的药品分别是?和?,f、g的作用是?。
(3)反应器为硬质玻璃管,纯净铁粉与氯气在500℃左右反应。
①化学反应方程式为?
②实验操作顺序是:组装仪器、?、装入药品、?、?、停止加热、关闭c的活塞。
(4)实验小组记录的实验现象如下:
?
| 观察到的部分现象
|
第一次实验
| 反应器中有白雾、红色固体、g瓶有白雾和黄绿色气体
|
第二次实验
| 反应器中有绿色晶体,g瓶有红棕色的烟和黄绿色气体
|
第三次实验
| 反应器中有绿色晶体,g瓶有黄绿色气体
|
?
①第一次实验,发现e瓶没有盛装任何药品,所以得到红色固体,其原因是?。
②第二次实验,g瓶有红棕色的烟,其原因是?。
(5)第三次实验得到的固体,最可能含有微量杂质是?,如果需要配制约2~3mol/L的染料还原剂溶液,则无需除去,理由是?。
参考答案:(1)2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O?(用次氯酸盐也可)
(2)饱和食盐水、浓硫酸?安全、防止倒吸?
(3) ①Fe+Cl2 ?FeCl2?②检验装置的气密性、先加热、 再打开c的活塞?
?FeCl2?②检验装置的气密性、先加热、 再打开c的活塞?
(4)①氯气没有干燥,生成的盐发生水解,生成了氢氧化物,最终分解得到三氧化二铁
②加热时温度没有维持至500℃左右,在温度较低时生成了氯化铁,由于氯化铁熔沸点低,受热时变成气体进入在g瓶中
(5)铁单质?铁单质可以防止Fe2+被氧化
本题解析:
?
?试题分析:在实验室中在常温下一般用高锰酸钾溶液和浓盐酸发生反应来制取氯气。反应的方程式为:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。(2)由于浓HCl有挥发性,而且反应是在溶液中制取的,所以氯气中含有杂质HCl和水蒸气。在d装置中用饱和的食盐水来除去HCl;在装置e盛装有浓硫酸来对氯气进行干燥。f、g的作用是作为安全瓶来防止倒吸现象的发生。(3)①纯净铁粉与氯气在500℃左右反应制取FeCl2。化学反应方程式为Fe+Cl2 FeCl2。②有气体参加的反应或制取气体的反应,在实验前一定要先检查装置的气密性,然后再进行实验。实验操作顺序是:组装仪器、检验装置的气密性、活塞、装入药品、先加热、再打开c的活塞、停止加热、关闭c的活塞。(4)①第一次实验,发现e瓶没有盛装任何药品,则氯气没有干燥,生成的盐发生水解,首先生成了氢氧化亚铁,在空气中被氧化为氢氧化铁,在灼烧时发生分解反应,最终得到红棕色的三氧化二铁。②第二次实验,加热时温度没有维持至500℃左右,在温度较低时生成了氯化铁,由于氯化铁熔沸点低,受热时变成气体进入在g瓶中,使g瓶有红棕色的烟。(5)第三次实验得到的固体,最可能含有微量杂质是金属Fe的单质。如果需要配制约2~3mol/L的染料还原剂溶液,由于Fe2+容易被空气中的氧气氧化,而铁单质可以防止Fe2+被氧化,因此该杂质无需除去。考点:
FeCl2。②有气体参加的反应或制取气体的反应,在实验前一定要先检查装置的气密性,然后再进行实验。实验操作顺序是:组装仪器、检验装置的气密性、活塞、装入药品、先加热、再打开c的活塞、停止加热、关闭c的活塞。(4)①第一次实验,发现e瓶没有盛装任何药品,则氯气没有干燥,生成的盐发生水解,首先生成了氢氧化亚铁,在空气中被氧化为氢氧化铁,在灼烧时发生分解反应,最终得到红棕色的三氧化二铁。②第二次实验,加热时温度没有维持至500℃左右,在温度较低时生成了氯化铁,由于氯化铁熔沸点低,受热时变成气体进入在g瓶中,使g瓶有红棕色的烟。(5)第三次实验得到的固体,最可能含有微量杂质是金属Fe的单质。如果需要配制约2~3mol/L的染料还原剂溶液,由于Fe2+容易被空气中的氧气氧化,而铁单质可以防止Fe2+被氧化,因此该杂质无需除去。考点:
本题难度:一般
5、填空题 (15分)氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂和生产含氟牙膏等。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵: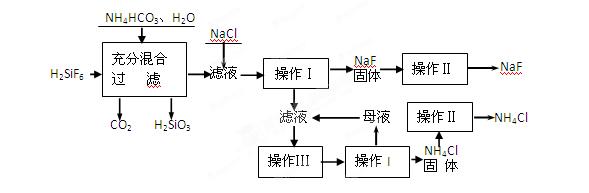
有关物质在水中溶解度(g/100gH2O)如下:
温度
| 10℃
| 20℃
| 30℃
| 溶解度:20℃NaF—4? 0℃NH4F—100;
常温Na2SiF6微溶于水
|
NH4Cl溶解度
| 33 .3 .3
| 37.2
| 41.4
|
?
请回答下列问题:
(1)操作Ⅰ需要用到的玻璃仪器有?。
(2)上述流程中发生两步反应,化学方程式为:
? ?
? ?
?
(3)操作II的作用是? ?
操作Ⅲ的具体过程是?
(4)流程中NH4HCO3必须过量,其原因是? ?
_______________________________________________________________________
参考答案:(15分)(1)玻璃棒、烧杯、普通漏斗(2分)

(4)保证H2SiF6能全部反应(2分);防止在加入NaCl后,H2SiF6与NaCl反应生成Na2SiF6沉淀,混入NaF中,影响NaF纯度(2分)
本题解析:略
本题难度:一般