1、选择题 X、Y、Z三种短周期元素,X原子的最外层电子数是次外层电子数的2倍,Y原子的次外层电子数是最外层电子数的2倍,Z原子的次外层电子数是最外层电子数的4倍.则X、Y、Z三种元素,可能的组合是( )
A.C、Si、Mg
B.Li、C、Mg
C.C、Mg、Li
D.C、O、Mg
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列各组微粒中,各能层电子数均达到2n2个的是
[? ]
A. Ne和 Ar
B. F-和S2-
C. Ne和Cl-
D. H+和Na+
参考答案:D
本题解析:
本题难度:简单
3、填空题 下表中列出五种短周期元素A、B、C、D、E的信息,请推断后作答:
| 元素 | 有关信息
A
元素主要化合价为-2,原子半径为0.074n?m
B
所在主族序数与所在周期序数之差为4
C
原子半径为0.102n?m,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰
D
最高价氧化物的水化物,能按1:1电离出电子数相等的阴、阳离子
E
原子半径为0.075n?m,最高价氧化物的水化物与其氢化物组成一种盐X
|
(1)画出B的离子结构示意图______;写出D元素最高价氧化物的水化物电子式______.
(2)盐X水溶液显______(填“酸”“碱”“中”)性,用离子方程式解释其原因______.
(3)D2CA3的溶液与B的单质能发生反应,其反应的离子方程式为______.
(4)已知E元素的某种氢化物Y与A2的摩尔质量相同.Y与空气组成的燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液.该燃料电池放电时,正极的电极反应式是______.
(5)如图是一个电解过程示意图.假设使用Y-空气燃料电池作为本过程的电源,铜片质量变化128g,则Y一空气燃料电池理论上消耗标准状况下的空气(设空气中氧气的体积含量为20%)______L.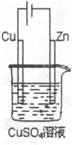
参考答案:A元素主要化合价为-2,原子半径为0.074nm,则A处于第ⅥA族;
C原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰,则C为S元素,A为O元素;
B所在主族序数与所在周期序数之差为4,满足该条件元素为O或Cl,由于A为O元素,则B为Cl元素.
E原子半径为0.075n?m,最高价氧化物的水化物与其氢化物组成一种盐X,则E为N元素,X为NH4NO3.
D最高价氧化物的水化物,为酸或碱,能按1:1电离出电子数相等的阴、阳离子,则D为Na元素.
即A为O元素,B为Cl元素,C为S元素,D为Na元素,E为N元素.X为NH4NO3.
(1)B为Cl元素,氯离子质子数为17,核外有18个电子,有3个电子层,最外层有8个电子,氯离子原子结构示意图为
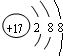
;D为Na元素,最高价氧化物的水化物为NaOH,NaOH是离子化合物,由钠离子和氢氧根离子构成,其电子式为
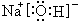
.
故答案为:
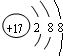
;
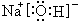
.
(2)X为NH4NO3,是强酸弱碱盐,铵根离子水解NH4++H2O

NH3?H2O+H+,溶液呈酸性.
故答案为:酸;NH4++H2O

NH3?H2O+H+.
(3)Cl2具有强氧化性,Na2SO3有较强的还原性,氯气能将亚硫酸根氧化为硫酸根,反应离子方程式:SO32-+Cl2+H2O=SO42-+2H++2Cl-.
故答案为:SO32-+Cl2+H2O=SO42-+2H++2Cl-.
(4)A2的为O2,摩尔质量为32g/mol,所以N元素的氢化物Y的摩尔质量为32g/mol,氢化物Y为N2H4,原电池正极发生还原反应,所以氧气在正极放电生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-.
故答案为:O2+2H2O+4e-=4OH-.
(5)铜为阳极,发生氧化反应,铜片质量变化128g,转移电子的物质的量为128g64g/mol×2=4mol,由O2+2H2O+4e-=4OH-可知,电池需消耗氧气1mol,标准状况下,氧气的体积为1mol×22.4L/mol=22.4L,所以需空气体积为22.4L20%=112L.
故答案为:112L.
本题解析:
本题难度:一般
4、选择题 A、B、C、D都是周期表中前20号元素,已知A的阳离子和C的阴离子具有相同的核外电子排布,且能形成组成为AC的化合物;C和D属同主族,其中C的核外电子数是D的核内质子数的2倍.B和D是同周期元素且A和B能形成AB2型化合物.下列说法中正确的是( )
A.D元素处于元素周期表中第二周期Ⅵ族
B.BC2分子一定是极性分子
C.AB2中可能既有离子键又有共价键
D.四种元素的原子半径大小一定是A>C>D>B
参考答案:解;C和D属同主族,其中C的核外电子数是D的核内质子数的2倍,则C为S元素,D为O元素,A的阳离子和C的阴离子具有相同的核外电子排布,且能形成组成为AC的化合物,则A在周期表第四周期,第ⅡA族,应为Ca元素,B和D是同周期元素且A和B能形成AB2型化合物,则B为C元素或F元素,形成的化合物为CaF2或CaC2,
A、D为O元素,处于元素周期表中第二周期ⅥA族,故A错误;
B、若BC2分子为CS2,为直线形分子,结构对称,是非极性分子,故B错误;
C、如AB2是CaC2,则既有离子键又有共价键,故C正确;
D、如B是C元素,则四种元素的原子半径大小顺序是A>C>B>D,故D错误.
故选C.
本题解析:
本题难度:一般
5、简答题 B、C、D、E均是短周期元素,原子序数依次增大,B元素原子最外层上的电子数为内层电子总数的2倍.B元素原子和C元素原子最外层电子数之差为2.C和D形成的化合物进行焰色反应火焰呈黄色.E元素的气态单质、E的最高价氧化物的水化物均能与D的最高价氧化物的水化物反应.
(1)上述4种元素按照原子序数由大到小排列为______、______、______、______;(填元素符号);
(2)B、C形成的化合物(比空气重)的结构式为______;
(3)C、D的单质在加热条件下生成物质X,其中含有化学键的类型为______;X的电子式为______;
(4)E的离子结构示意图为______;
(5)Y是C的气态氢化物.常温下,将D的单质投入Y中,发生反应的离子方程式为______;该反应______(填“能”、“不能”)作为设计原电池的反应原理.
参考答案:B、C、D、E均是短周期元素,B元素原子最外层上的电子数为内层电子总数的2倍,原子只能有2个电子层,最外层电子数为4,则B为碳元素;B元素原子和C元素原子最外层电子数之差为2,则C元素原子最外层电子数为6或2,C和D形成的化合物进行焰色反应火焰呈黄色,含有钠元素,则D为Na元素,C不能是金属元素,C的原子序数小于Na,故C为氧元素;E元素的气态单质、E的最高价氧化物的水化物均能与D的最高价氧化物的水化物NaOH反应,则E为Cl元素,
(1)上述4种元素按照原子序数由大到小排列为:Cl、Na、O、C,
故答案为:Cl;Na;O;C;
(2)C、O形成的化合物(比空气重)为CO2,分子中C原子与O原子之间形成2对共用电子对,其结构式为 O=C=O,故答案为:O=C=O;
(3)O、Na的单质在加热条件下生成物质X为Na2O2,含有离子键、共价键,其电子式为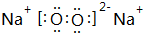 ,
,
故答案为:离子键、共价键; ;
;
(4)E为Cl元素,其离子结构示意图为 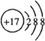 ,故答案为:
,故答案为: ;
;
(5)常温下,将Na的单质投入水中,发生反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,该反应属于氧化还原反应,能作为设计原电池的反应原理,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;能.
本题解析:
本题难度:一般