1、填空题 物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子浓度由大到小的顺序为?。
(2)B为0.1 mol·L-1 NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:?。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入?,目的是?;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为?。
参考答案:(1)c(NH4+)>c(SO42-)>c(H+)>c(OH-)
(2)HCO3-发生水解反应使溶液中c(OH-)>c(H+)
(3)盐酸抑制Fe3+水解? Fe3++3HCO3-=Fe(OH)3↓+3CO2↑
本题解析:(1)(NH4)2SO4=2NH4++SO42-,NH4+微弱水解使溶液显酸性,故c(NH4+)>c(SO42-)>c(H+)>c(OH-)。
(2)HCO3-以发生水解反应HCO3-+H2O H2CO3+OH-为主,发生电离HCO3-
H2CO3+OH-为主,发生电离HCO3- H++CO32-为次,因此溶液中c(OH-)>c(H+),溶液呈碱性。
H++CO32-为次,因此溶液中c(OH-)>c(H+),溶液呈碱性。
(3)Fe3++3H2O Fe(OH)3+3H+,为抑制Fe3+水解,应加入少量HCl; Fe3+与HCO3-因互相促进水解而产生Fe(OH)3沉淀和CO2气体。
Fe(OH)3+3H+,为抑制Fe3+水解,应加入少量HCl; Fe3+与HCO3-因互相促进水解而产生Fe(OH)3沉淀和CO2气体。
本题难度:简单
2、填空题 比较下列化学反应后所得溶液中各离子浓度的大小。
①10ml的0.2mol·L-1的HCl与10ml的0.2mol·L-1氢水混和所得溶液中各离子浓度由大到小的顺序是?。
②10ml的0.4mol·L-1的CH3COONa溶液与10ml的0.2mol·L-1的HCl溶液混合后,所得溶液中各离子浓度由大到小的顺序是?
参考答案:①[Cl-]>[NH4+]>[H+]>[OH-]
②[Na+]>[CH3COO-]>[Cl-]>[H+]>[OH-]
本题解析:①盐酸可以与氨水发生反应
HCl+NH3·H2O=NH4Cl+H2O
而题中所溶HCl与NH3·H2O物质的量相同恰好完全反应,相当于所给NH4Cl溶液。发生如下反应:
NH4Cl=NH4++Cl-;NH4++H2O NH3·H2O+H+
NH3·H2O+H+
因为部分NH4+水解而消耗所以[Cl-]>[NH4+]。
又因为水解的NH4+仅占全部极少部分,因而生成的H+也很小,导致[NH4+]>[H+]
而且NH4Cl为强酸弱碱盐,溶液显酸性,因而[H+]>[OH-]
②CH3COONa+HCl=NaCl+CH3COOH ,
反应中醋酸钠是过量的,反应所得的溶液为各是0.1mol/L的NaCl、CH3COONa、CH3COOH的混和物。
CH3COONa=CH3COO-+Na+
NaCl=Na++Cl-
CH3COOH CH3COO-+H+
CH3COO-+H+
因而[Na+]最大,由于除CH3COONa之外,CH3COOH也电离出少量的CH3COO-,导致[CH3COO-]>[Cl-];由于溶液中存在大量CH3COOH,所以溶液显酸性[H+]>[OH-],CH3COOH为弱电解质,电离出的[H+]极少,小于[Cl-]的浓度。
本题难度:简单
3、选择题 有一种酸式盐AHB,它的水溶液呈弱碱性。则以下说法:
①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB-的水解程度;
④该盐溶液的电离方程式一般写成:AHB====A++HB-,HB- H++B2-
H++B2-
其中错误选项的组合是(? )
A.①②
B.③④
C.②③
D.①④
参考答案:B
本题解析:酸式盐AHB的水溶液呈弱碱性,说明AOH的碱性相对较强,H2B的酸性相对较弱,且HB-的电离程度小于HB-的水解程度,相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度。AHB溶液的电离方程式一般写成AHB====A++HB-,HB- H++B2-
H++B2-
本题难度:一般
4、选择题 下列物质的溶液加热蒸发至干、灼烧,所得固体的成分不相同的是(?)
A.FeCl2、Fe2(SO4)3
B.FeCl2、FeCl3
C.NaHCO3、Na2CO3
D.Mg(HCO3)2、MgCl2
参考答案:A
本题解析:略
本题难度:一般
5、选择题 已知某溶液中存在 四种离子,其浓度大小有如下关系
四种离子,其浓度大小有如下关系
①
②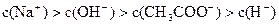
③
④
其中正确的是?(?)
A.①②③
B.①②④
C.①③④
D.②③④
参考答案:B
本题解析:略
本题难度:简单