1、选择题 25℃时,有浓度均为1 mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液,若测得其中c(NH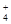 )分别为?a、b、c(单位为mol/L),则下列判断正确的是
)分别为?a、b、c(单位为mol/L),则下列判断正确的是
A.a=b=c
B.c>a>b
C.b>a>c
D.a>c>b
参考答案:B
本题解析:NH4+水解溶液显酸性,而CO32-水解溶液显碱性,铁离子水解溶液显酸性,所以碳酸铵中NH4+水解程度最大,(NH4)2Fe(SO4)2中NH4+水解程度最小,因此答案选B。
点评:本题是基础性试题的考查,难度不大。学生只要能熟练运用勒夏特例原理即不能得出答案。
本题难度:一般
2、选择题 下列物质的溶液在蒸发皿加热蒸干、灼烧,可以得到该物质固体的是?
[? ]
A.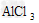 ?
?
B.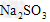 ?
?
C.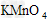 ?
?
D.
参考答案:D
本题解析:
本题难度:一般
3、填空题 以下是25℃时几种难溶电解质的溶解度:
难容电解质
| Mg(OH)2
| Cu(OH)2
| Fe(OH)2
| Fe(OH)3
|
溶解度/g
| 9×10-4
| 1.7×10-6
| 1.5×10-4
| 3.0×10-9
|
?
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤后结晶。
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的Mg(OH)2,充分反应,过滤后结晶。
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤后结晶。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为?而除去。
(2)①中加入的试剂应该选择?为宜。
(3)②中除去Fe3+所发生的总反应的离子方程式为?。
(4)下列与方案③相关的叙述中,正确的是?(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在
参考答案:(1)氢氧化铁? (2)氨水
(3)2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3
(4)A、C、D、E
本题解析:①中为了不引入杂质离子,应加入氨水使Fe3+沉淀,而不能用NaOH溶液。②中根据溶解度表可明确Mg(OH)2能较容易转化为Fe(OH)3,因此在MgCl2溶液中加入足量Mg(OH)2可除去Fe3+,然后将沉淀一并过滤。③中利用高价阳离子Fe3+极易水解的特点,据题意可知调节溶液的pH=4可使Fe3+沉淀完全,为了不引入杂质离子,因此可使用CuO、Cu(OH)2、CuCO3等调节溶液的pH。
本题难度:简单
4、选择题 向浓度为0.1 mol·L-1的K2CO3溶液中,分别加入下列物质, 能使c(CO32- )增大的是?
[? ]
A.H2O
B.CO2
C.K2S
D.KOH
参考答案:CD
本题解析:
本题难度:一般
5、选择题 下列叙述正确的是(?)
A.浓度均为0.1 mol·L-1的CH3COOH与CH3COONa溶液等体积混合后溶液显酸性,
则:c(CH3COO-)<c(CH3COOH)
B.浓度均为0.1 mol·L-1的氨水与盐酸等体积混合后的溶液中:c(H+)=c(OH-) + c(NH3·H2O)
C.浓度均为0.1 mol·L-1的小苏打溶液和氢氧化钠溶液等体积混合:c(Na+)+ c(H+)= c(CO32-)+ c(OH-) + c(HCO3-)
D.用pH=3的盐酸滴定10 mL pH=11的氨水,达到滴定终点用去盐酸的体积小于10 mL
参考答案:B
本题解析:浓度均为0.1 mol·L-1的CH3COOH与CH3COONa溶液等体积混合后溶液显酸性,说明醋酸的电离大于水解,所以c(CH3COO-)>c(CH3COOH),故A错误;浓度均为0.1 mol·L-1的氨水与盐酸等体积混合后的溶液中,根据质子守恒,可以得到c(H+)=c(OH-) + c(NH3·H2O),故B正确;浓度均为0.1 mol·L-1的小苏打溶液和氢氧化钠溶液等体积混合得到浓度为0.05mol·L-1的碳酸钠溶液,在该溶液中,根据电荷守恒可以得到c(Na+)+ c(H+)= 2c(CO32-)+ c(OH-) + c(HCO3-),所以C错误;用pH=3的盐酸滴定10 mL pH=11的氨水,达到终点用去盐酸的体积大于10 mL,故D错误。
点评:本题考查了盐类水解,质子守恒,电荷守恒的知识,这些知识是高考考查的重点和难点,本题有一定的综合性,难度适中。
本题难度:简单