1、填空题 .(10分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种,且均符合勒夏特列原理。
(1)在固定容积的密闭容器中,反应A(g)+2B(g) 4C(g),
4C(g),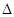 H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是? __
H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是? __
A.增加B的物质的量? B.加压? C.升温? D.使用催化剂
(2)某溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH) ____c(CH3COOH),混合后溶液中c(CH3COO-)____c(Na+)
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒(不考虑Zn粒对反应速率的影响),反应过程中两溶液的pH变化如下图所示。

则图中表示醋酸溶液中pH变化曲线的是?(填A或B)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1?m2(选填<﹑=﹑>)
参考答案:(1)AC(每个1分)?(2)< ;=?(3)B; <
本题解析:(1)反应是条件增大、吸热发热可逆反应,所以要增大A的转化率,平衡应该向正反应方向移动,所以选项AC均可以。加压平衡向逆反应方向移动。催化剂不能改变平衡状态。所以正确的答案是AC。
(2)若恰好反应,则生成物醋酸钠水解显碱性,因此要显中性,醋酸一定是过量的。即氢氧化钠的浓度小于醋酸的。
(3)醋酸是弱电解质,存在电离平衡。在反应过程中会继续电离出氢离子,所以醋酸中氢离子的浓度变化程度小于盐酸。因此要使反应后的pH相等,则醋酸需要的时间就多,即B表示醋酸的。醋酸中消耗的氢离子多,则相应的锌消耗的也就多。
本题难度:一般
2、选择题 关于化学平衡常数,下列说法不正确的是( )?
A.化学平衡常数不随反应物或生成物的浓度的改变而改变?
B.化学平衡常数随温度的改变而改变?
C.对于一定温度下的同一个反应,其正反应和逆反应的化学平衡常数的乘积等于1?
D.温度越高,K值越大
参考答案:D
本题解析:化学平衡常数K=生成物浓度幂的积/反应物浓度幂的积, 化学平衡常数只与温度有关,与物质的浓度无关.故A、B正确
根据化学平衡常数的计算式可以知道对于一定温度下的同一个反应,其正反应和逆反应的化学平衡常数的乘积等于1,故C正确。
D、虽然化学平衡常数只与温度有关,对于吸热反应,温度越高,平衡向正反应方向移动,,K越大,但是放热反应,温度越高,平衡向逆反应方向移动,K越小,故错
点评:本题考查了化学平衡常数的含义,难度不大,注意化学平衡常数只与温度有关,这是解题的关键。
本题难度:一般
3、选择题 有关化学平衡常数(K)的说法中不正确的是(?)
A.K值越大,正反应进行的程度越大
B.一般地说,K>105时,该反应进行得就基本完全了
C.压强越大,K值越大
D.K与反应物或生成物的浓度变化无关
参考答案:C
本题解析: K值越大,正反应进行的程度越大,故A正确;一般地说,K>105时,该反应进行得就基本完全了,故B正确;对于如A(g)+B(g)  C(g)+D(g)的反应,压强对其没有影响,故压强越大,K值不一定越大,故C错误,为本题的正确答案;K与反应物或生成物的浓度变化无关,对于一个给定的反应,K的值只与温度有关,故D正确。
C(g)+D(g)的反应,压强对其没有影响,故压强越大,K值不一定越大,故C错误,为本题的正确答案;K与反应物或生成物的浓度变化无关,对于一个给定的反应,K的值只与温度有关,故D正确。
点评:本题考查了化学平衡常数,该考点是高考考查的重点和难度,本题要掌握的是平衡常数只与温度有关,K值越大,正反应进行的程度越大 ,本题难度适中。
本题难度:一般
4、选择题 恒温下, 反应aX(g)? ?bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确的是:
?bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确的是:
A.a>b+c
B.a<b+c
C.a=b+c
D.a=b="c"
参考答案:A
本题解析:把容器体积压缩到原来的一半瞬间,X的浓度变为0.2mol/L,但最终平衡时浓度是0.19mol/L,这说明。增大压强平衡向正反应方向移动,即正反应是体积减小的,答案选A。【题型】选择题
本题难度:一般
5、选择题 近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视。某研究小组利用反应:CO(g)+H2O(g) H2(g)+CO2(g) ΔH="-41.2" kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
H2(g)+CO2(g) ΔH="-41.2" kJ/mol制备CO2与H2的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用。
(1)已知:850 ℃时在一体积为10 L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图所示:
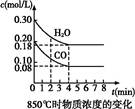
下列说法正确的是(? )?
A.达到平衡时,氢气的物质的量是0.12 mol
B.达到平衡时,反应体系最终会放出49.44 kJ热量
C.第4 min时,混合气体的平均相对分子质量不再变化
D.第6 min时,若升高温度,反应平衡常数会减小
参考答案:BCD
本题解析:试题分析:
本题难度:一般