1、选择题 一定温度下,把2. 0体积的N2和6. 0体积的H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通,容器中发生如下反应:N2+3H2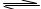 2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是
2NH3。已知平衡时NH3的浓度是c mol·L-1,现按下列四种配比作为起始物质,分别充入上述容器,并保持温度不变,则达到平衡后,NH3的浓度不为c mol·L-1的是
A.1.0体积的N2和3.0体积的H2
B.2.0体积的N2、6.0体积的H2和4.0体积的NH3
C.4.0体积的NH3和1.0体积的H2
D.2.0体积的NH3
参考答案:C
本题解析:在等温等压情况下的等效平衡,只要求反应物的量担按系数比转化为半边后,两反应物的量的比例符合1:3即可。
本题难度:一般
2、选择题 某温度下,反应H2(g)+I2(g) ?2HI(g),△H <0,在一带有活塞的密闭容器中达到平衡,
?2HI(g),△H <0,在一带有活塞的密闭容器中达到平衡,
下列说法不正确的是(? )
A.恒温压缩体积,平衡不移动,颜色加深
B.恒压迅速充入HI,开始时正反应速率减小
C.恒容,升温正反应速率减小
D.恒容,充入H2,I2的百分比含量降低
参考答案:C
本题解析:A正确,该反应为等体积反应,压缩体积,平衡不移动,但各组分的浓度均成倍变化;B正确,恒压充入生成物,容器体积增大,反应物的浓度减小,正反应速率开始时速率减小,而开始时逆反应速率突然增大;C错,恒容,升温正反应速率增大;D正确,恒容,充入H2,I2的转化率增大,再次平衡时百分比含量降低。
本题难度:一般
3、选择题 如图所示曲线表示其它条件一定时反应2NO(g)+O2(g) 2NO2(g)?△H<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达平衡状态且V(正)>V(逆)的点是
2NO2(g)?△H<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达平衡状态且V(正)>V(逆)的点是

A.a点
B.b点
C.c 点
D.d点
参考答案:C
本题解析:在曲线上,当温度一定时,NO的转化率也一定,故曲线上任意一点都表示达到平衡状态,而曲线外的任意一点都表示未达平衡状态。在曲线下方的任意一点,要想达到同温度下的平衡状态,应该向上引垂直线到曲线上的一点,这样NO的转化率要增大,平衡向右移动;而在曲线上方的任意一点,要想达到同温度下的平衡状态,则应该向下引垂直线到曲线上的一点,这样NO的转化率要减小,平衡向左移动,据此解答。A、a点在曲线上,处于平衡状态,v(正)=v(逆),故A错误;B、b点在曲线上,处于平衡状态,v(正)=v(逆),故B错误;C、c点在曲线下方,未达到平衡状态,要想达到同温度下的平衡状态,需要由c点向上引垂直线到曲线上的一点,这样NO的转化率要增大,平衡向右移动,故v(正)>v(逆),因此C正确;D、d点在曲线上方,未达到平衡状态,要想达到同温度下的平衡状态,需要由d点向下引垂直线到曲线上的一点,这样NO的转化率要减小,平衡向左移动,故v(正)<v(逆),因此D错误,答案选C。
本题难度:一般
4、填空题 (10分)在某2 L的密闭容器中加入0.1 mol碘单质和足量钨(W),在943 K时,发生反应W(s)+I2(g) WI2(g),当I2的转化率为20%时,达化学平衡状态。
WI2(g),当I2的转化率为20%时,达化学平衡状态。
(1)反应从开始至平衡状态过程中用时20 s,其平均反应速率v(WI2)为________。
(2)943 K时,该反应的平衡常数K=________。
(3)若起始时,加入的碘为0.2 mol(其他条件不变)达平衡时容器中气体的体积比
V(I2)∶V(WI2)=________。
(4)在上述(1)平衡状态下,同时增加I2(g)和WI2(g)各0.02 mol(其他条件不变),化学平衡向________(填“正反应”或“逆反应”)方向移动,判断的依据是______________________。
参考答案:(1)5×10-4mol·L-1·s-1?(2)0.25 (3)4∶1 (4)逆反应 Qc=0.4>K=0.25
本题解析:(1)I2的物质的量的变化="0.1" mol×20%=0.02mol;则根据化学反应速率=浓度的变化量除以时间可得V(I2)=5×10-4mol·L-1·s-1 ,再根据同一化学反应方程式中,速率之比等于化学计量数之比,所以,v(WI2)5×10-4mol·L-1·s-1 ,
(2)平衡常数=平衡后,生成物浓度幂之积与反应物浓度幂之积的比值,在这个表达式中,固体、纯液体的浓度是一个常数,不列入平衡常数表达式中,所以,可计算求得该反应的平衡常数K=0.25
(3)反应W(s)+I2(g) WI2(g)为等体积反应,若起始时,加入的碘为0.2 mol,则该平衡不移动,所以,平衡时容器中气体的体积比V(I2)∶V(WI2)为原体系下的体积比,在相同条件下,体积之比等于物质的量之比,即可求得V(I2)∶V(WI2)=4∶1
WI2(g)为等体积反应,若起始时,加入的碘为0.2 mol,则该平衡不移动,所以,平衡时容器中气体的体积比V(I2)∶V(WI2)为原体系下的体积比,在相同条件下,体积之比等于物质的量之比,即可求得V(I2)∶V(WI2)=4∶1
(4)判断化学平衡的移动方向可根据浓度商Qc与K的大小分析;若Qc大于K,则向逆反应方向移动;若Qc等于K,则平衡不移动;若Qc小于K,则平衡向正反应方向移动。
本题难度:一般
5、填空题 (12分)在一定温度下的2 L密闭容器中充入0.4 mol SO2和0.2 mol O2 ,发生反应:2SO2(g)+O2(g)  2SO3(g)? ΔH <0,n(O2)随时间的变化如图实线所示:
2SO3(g)? ΔH <0,n(O2)随时间的变化如图实线所示:

(1)用SO2表示0~4 min内该反应的平均速率为?。该温度下反应的平衡常数K为?。升高温度K值??(填“增大”、“不变”或“减小”)。?
(2)若温度不变,在容器中再加1 mol O2 ,重新达到平衡,则SO2的平衡浓度?
(填“增大”、“不变”或“减小”),氧气的转化率?(填“升高”、“不变”或“降低”),SO3的体积分数?(填“增大”、“不变”或“减小”)。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_____________________________,曲线II对应的实验条件改变是______________________________________。
参考答案:(1)0.025 mol/(L·min)(2分)? 20(2分)?减小(1分)
(2)减小(1分)?降低(1分)?减小(1分)
(3)升高温度(2分)?增大压强(2分)
本题解析:(1)化学反应速率通常用单位时间内浓度的变化量来表示。0~4 min内氧气减少了0.1mol,则同时消耗二氧化硫是0.2mol,所以用SO2表示0~4 min内该反应的平均速率为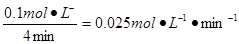 。平衡是容器内氧气、二氧化硫、三氧化硫的浓度分别是0.05mol/L、0.1mol/L、0.1mol/L,所以平衡常数是
。平衡是容器内氧气、二氧化硫、三氧化硫的浓度分别是0.05mol/L、0.1mol/L、0.1mol/L,所以平衡常数是 。因为反应是放热反应,所以温度升高平衡向逆反应方向移动,即平衡常数减小。
。因为反应是放热反应,所以温度升高平衡向逆反应方向移动,即平衡常数减小。
(2)再加入1mol氧气,氧气浓度增大,平衡向正反应方向移动,提高二氧化硫的转化率,所以SO2的平衡浓度将减小,但氧气的转化率将减小。根据(1)可计算出平衡时二氧化硫的体积分数是40%。通入1mol氧气,若二氧化硫全部生成三氧化硫才是0.4mol,此时其体积分数是2/7,所以其体积分数减小。
(3)曲线I和原来相比,达到平衡的时间少了,但氧气的转化率降低了,所以只能是升高温度。曲线Ⅱ和原来相比,达到平衡的时间也少了,但氧气的转化率增大了,所以只能是增大压强。
本题难度:简单