1、选择题 对下列事实的解释错误的是(? )
A.氨溶于水的喷泉实验,说明氨气极易溶于水
B.常温下,将铜放入浓硫酸中无明显变化,说明铜在冷的浓硫酸中钝化
C.浓硝酸久置显黄色,说明浓硝酸具有不稳定性
D.向胆矾中加入浓硫酸后出现白色的现象,说明浓H2SO4具有吸水性
参考答案:B
本题解析:A、氨气极易溶于水,可做氨溶于水的喷泉实验,正确;B、常温下,铜与浓硫酸不反应,但钝化是指反应产生的氧化膜阻止了反应的进行,错误;C、浓硝酸久置会分解产生二氧化氮气体溶于硝酸中使硝酸显黄色,正确;D、向胆矾中加入浓硫酸后出现白色的现象,是胆矾失去结晶水后变为白色固体,说明浓H2SO4具有吸水性,正确,答案选B。
本题难度:简单
2、选择题 往FeCl3和BaCl2的混合溶液中通入SO2,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。下列说法正确的是( )
A.该实验表明FeCl3有还原性
B.白色沉淀为BaSO3
C.该实验表明SO2有漂白性
D.反应后溶液酸性增强
参考答案:D
本题解析:SO2具有还原性,铁离子具有氧化性,能被SO2氧化生成硫酸,进而和氯化钡反应生成硫酸钡白色沉淀,答案选D。2的性质
点评:该题是基础性试题的考查,侧重对SO2化学性质的检验与训练,难度不大。该题的关键是熟练记住SO2的化学性质,特别是SO2漂白性与还原性的判断,有利于培养学生的逻辑推理能力。
本题难度:简单
3、填空题 有一纯净的亚硫酸钠晶体因部分被氧化而变质,为了测定样品中杂质的质量分数进行以下实验过程,按要求填写空格:
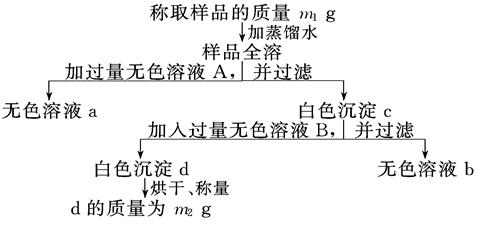
(1)向混合溶液中加入的无色溶液A是____________(填化学式),A必须过量的原因是
________________________________________________________________________.
(2)白色沉淀c中含有____________________(填化学式).
(3)无色溶液B通常是_____________(填试剂名称),加入后与c反应的离子方程式为
________________________________________________________________________.
(4)通过以上测定可得到样品中杂质的质量分数的计算式为_______________________.
参考答案:(8分)(1)BaCl2(1分)使SO32-、SO42-沉淀完全(1分)(2)BaSO4、BaSO3(1分)
(3)稀盐酸(1分)2H++BaSO3=H2O+SO2↑+Ba2+(2分)(4)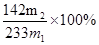 (2分)
(2分)
本题解析:(1)不论是亚硫酸钠,还是硫酸钠,都能和氯化钡溶液反应生成白色沉淀,据此可以检验和计算,所以A是氯化钡。氯化钡过量的目的是使使SO32-、SO42-沉淀完全。
(2)根据(1)中分析可知,白色沉淀c中含有BaSO4、BaSO3。
(3)要溶解亚硫酸钡,而又不能影响硫酸钡,则B应该是盐酸,不能用硝酸,因为硝酸具有氧化性,反应的方程式是2H++BaSO3=H2O+SO2↑+Ba2+。
(4)最终得到的白色沉淀d是硫酸钡,质量是m2g,则该原子守恒可知,样品中杂质的质量分数的计算式为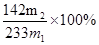 。
。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,难易适中,基础性强。在注重对学生基础知识巩固和训练的同时,侧重对学生实验能力的培养。有利于调动学生的学习兴趣,激发学生的学习积极性,也有利于培养学生的逻辑推理能力和规范严谨的实验设计能力和动手操作能力,提升学生的学科素养。
本题难度:一般
4、选择题 在氯化钡溶液中通入SO2,无白色沉淀产生。若将氯化钡溶液分装在两只试管中,一支加硝酸,另一支加NaOH溶液,然后再分别通入适量的SO2,结果两支试管中都有白色沉淀生成。由此得出下列结论正确的是
A.加入NaOH,溶液pH升高,c(SO32-)增大
B.氯化钡有两性
C.两支试管中的白色沉淀都是BaSO4
D.SO2具有两性且水溶液有酸性
参考答案:A
本题解析:略
本题难度:一般
5、填空题 以下是有关SO2、Cl2的性质实验。
(1)某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
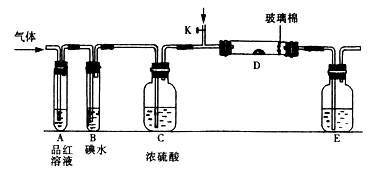
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同??(填“相同”或“不相同”);若D中盛铜粉,通入足量的Cl2,D中的现象是___________;若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为?。
②SO2通入B中,碘水褪色,则该反应的离子方程式为?。
③E中盛有______________溶液。
(2)某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母)?,则可以看到白色沉淀产生。
A.氨水
B.稀盐酸
C.稀硝酸
D.氯化钙溶液