1、实验题 (10分)利用催化剂可使NO和CO发生反应:2NO(g)+2C0(g) 2CO2(g)+N2(g) △H<0。
2CO2(g)+N2(g) △H<0。
已知增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。

(1)请填全表中的各空格;
(2)实验I中,NO的物质的量浓度(c)随时问(t)的变化如下图所示。请在给出的坐?标图中画出实验Ⅱ、III中NO的物质的量浓度(c)随时间(t)变化的曲线,并标明各曲线的实验编号。
2、填空题 探究外界条件对化学反应速率的影响常用到该反应
已知:Na2S2O3+H2SO4→Na2SO4+S↓+SO2+H2O
针对上述反应涉及到的元素或物质及性质回答有关问题:
23.硫元素的化合价由高到低顺序为:______________________________
涉及元素的简单离子半径由小到大顺序为:______________________________;
24.氧原子的最外层电子排布轨道表示式:______________________________;
列举2个能说明氧、硫两种元素非金属性强弱事实:______________________________;
25.预测镁在二氧化硫中燃烧的现象:________________________________________
产物除氧化镁、硫磺外还可能有 生成。
26.下面是某同学是根据该反应实验数据绘制的图表
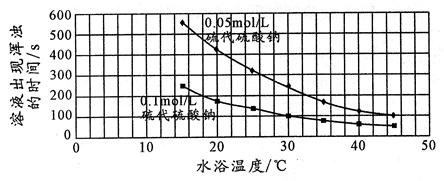
该同学得出的结论是:
_________________________________________________________________________________。
27.将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。
_________________________________________________________________________________。
若继续通入另两种气体如Cl2 和H2S也会产生沉淀,请用化学方程式表示生成沉淀的原理。
_________________________________________________________________________________。
3、选择题 四个试管中都装有5mL0.1mol·L-1Na2S2O3溶液,分别在不同温度下加入0.1mol·L-1硫酸和一定量水,最先出现浑浊的是
A.20℃,5 mL硫酸,2 mL水
B.20℃,4 mL硫酸,3 mL水
C.30℃,4 mL硫酸,3 mL水
D.30℃,5 mL硫酸,2 mL水
4、实验题 I.下列四支试管中,过氧化氢分解的化学反应速率最大的是?
试管
| 温度
| 过氧化氢浓度
| 催化剂
|
a
| 室温(25℃)
| 12%
| 有
|
b
| 水浴加热(50℃)
| 4%
| 无
|
c
| 水浴加热(50℃)
| 12%
| 有
|
d
| 室温(25℃)
| 4%
| 无
|
II.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号
| 反应物
| 催化剂
|
①
| 10mL2% H2O2溶液
| 无
|
②
| 10mL5% H2O2溶液
| 无
|
③
| 10mL5% H2O2溶液
| 1mL0.1mol·L-1FeCl3溶液
|
④
| 10mL5% H2O2溶液+少量HCl溶液
| 1mL0.1mol·L-1FeCl3溶液
|
⑤
| 10mL5% H2O2溶液+少量NaOH溶液
| 1mL0.1mol·L-1FeCl3溶液
|
(1)实验①和②的目的是____________________________。
(2)写出实验③的化学反应方程式?。
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。
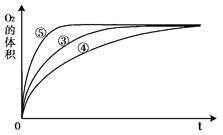
分析上图能够得出的实验结论是?_________________________。
5、实验题 (14分)某课外兴趣小组对双氧水(H2O2水溶液)做了如下实验探究。
(1)将质量相同但聚集状态不同的MnO2分别加入5mL 5%的双氧水中,并用带火星的木条试之。测定结果如下:
催化剂(MnO2)
| 操作情况
| 观察结果
| 反应完成所需的时间
|
粉末状
| 混合不振荡
| 剧烈反应,使木条复燃
| 3.5分钟
|
块状
|
| 反应较慢,火星红亮但木条未复燃
| 30分钟
|
①写出H2O2反应的化学方程式 。
②实验结果说明催化剂作用的大小与 有关。
(2)取三份含有等量H2O2,但质量分数不同的双氧水,分别向其中加入1克MnO2粉末。测定结果如下:
双氧水体积
| 操作情况
| 反应完成所需的时间
| 收集到气体体积
| 反应后液体温度
|
a1%的150mL
|
| 11分钟
| 539mL
| 24℃
|
a2%的15mL
| 混合不振荡
| 1分20秒
| 553mL
| 56℃
|
a3%的7.5mL
|
| 9秒
| 562mL
| 67℃
|
请简要说明:
①反应完成所需的时间不同的原因 。
②反应后液体温度不同的原因 。
③收集到气体体积不同的原因 。
(3)向含有酚酞的NaOH稀溶液中,逐滴滴入10%的双氧水,红色褪去。
①已知双氧水显弱酸性,试写出H2O2的电离方程式: 。
②小组讨论红色褪去的原因时,甲同学认为是双氧水显酸性所致;乙同学认为是双氧水有较强氧化性所致。请你设计一个简单实验来说明是甲对还是乙对。(简要文字说明)