1、选择题 碳原子的基态外围电子排布式正确的是
[? ]
A.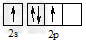
B.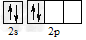
C.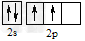
D.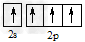
2、填空题 (三选一)【物质结构与性质】
(1)金属钛(22Ti)将是继铜、铁、铝之后人类广泛使用的第四种金属,写出钛元素的基态原核外电子排布式:_______________
(2)日常生活中广泛应用的不锈钢,在其生产过程中添加了铬元素,该元素基态原子未成对电子数为_____________。
(3)COCl2俗称光气,分子中碳原子采取_____________杂化成键;其中碳氧原子之间的共价键含有____(填字母)。
a.2个σ键 b.2个π键 c.1个σ键、1个π键
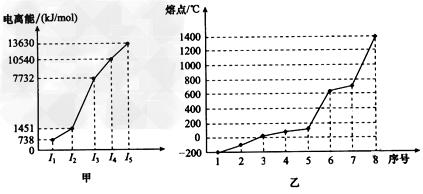
(4)①短周期某主族元素M的逐级电离能情况如图甲所示,则M元素形成化合物时表现的主要化合价为______价。
②第三周期8种元素按单质熔点高低的顺序如图乙所示,其中序号“8”代表_______(填元素符号,下同);其中电负性最大的是_________。
(5)由碳原子跟硅原子以1:1相互交替结合而形成的晶体,晶型与晶体Si相同。两者相比熔点更高的是________(填化学式),试从结构角度加以解释:______________
(6)在配合物Fe(SCN)2+中,提供空轨道接受孤对电子的微粒是_________________
3、填空题 超细铜粉主要应用于导电材料、催化剂等领域中。超细铜粉的制备方法如下:

试回答下列问题:
(1)ECu(NH3)4]SO4的组成元素中电负性最大的是__________ (填元素符号),SO42-的空间构型为____。
(2)NH4CuSO3中金属阳离子的化合价为__________ ,SO32-中硫原子的杂化方式为________ ,写出与其互为等电子体的一种分子的分子式:___________ 。
(3)NH4CuSO3与硫酸微热反应的离子方程式为____。
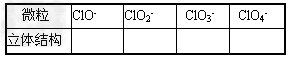
4、填空题 在ClO-、ClO2-、ClO3-、ClO4-中Cl都是以sp3杂化轨道与O原子成键的,试推测下列微粒的立体结构
5、填空题 (1) 2010年11月,日本东京大学的几原雄一教授在研究氢与钒(V)的化合物时捕捉到了氢原子,成功拍下 了世界首张氢原子的照片。如图所示是氢钒化合物的晶体构造。

①写出基态钒原子的核外电子排布式________________。
②该氢钒化合物的化学式为____________。
(2) 2010年8月,澳大利亚悉尼大学陈敏(Min Chen)博士等研究人员发现了一种能吸收红外光谱的
叶绿素-f,这是迄今为止发现的第五种叶绿素。下图是某叶绿素的结构简式。

①叶绿素中含有C、H、O、N、Mg五种元素,C、N、O三种元素的第一电离能由小到大的顺序是____。 ②叶绿素中氮原子的杂化方式为_________,在下图的方框内用“→”标出Mg2+的配位键。