1、简答题 下列是A、B、C、D、E五种短周期元素的某些性质
| A | B | C | D | E
化合价
-4
-2
-1
-2
-1
电负性
2.5
2.5
3.0
3.5
4.0
|
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是______
A.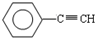 B.CH4C.CH2=CHCH3 D.CH3CH2C≡CHE.CH3CH3
B.CH4C.CH2=CHCH3 D.CH3CH2C≡CHE.CH3CH3
(2)与AD2互为等电子体的分子、离子的化学式依次为______、______(各写1种)
(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是______(写分子式),理由是______.
2、简答题 根据杂化理论回答下列问题。

(1)上表中各物质中心原子是否以杂化轨道成键?以何种类型杂化轨道成键?
_______________________________
(2)NH3和H2O的键角为什么比CH4小?CO2的键角为何是180°?C2H4的键角又为何是120°?
_______________________________
3、简答题 常用于除去高速公路冰雪的是“氧盐类”融雪剂,如NaCl、MgCl2等.请回答
(1)“氯盐类”融雪剂主要成分的晶体类型为______;
(2)冰比硫化氢溶点高的原因是______,其分子中氧原子的杂化轨道类型为______;
(3)已知X、Y和Z为第三周期元素,其原子的第一至第四电离能如下表:
| 电离能/kJ?mol-1 | I1 | ?I2 | I3 | I4
X
578
1817
2745
11578
Y
738
1451
7733
10540
Z
496
4562
6912
9543
|
则X、Y、Z的电负性从大到小的顺序为______(用元素符号表示),元素Y的第一电离能大于X的原因是______;
(4)融雪时刻对环境危害很大,如和路基上的铁等金属形成原电池,会加快路面面破损.铁元素应用广泛,Fe2+与KCN溶液反应得Fe(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成黄血盐,其配离子结构如图.
①铁元素基态原子价电子排布式为______;
②已知CN-与N2结构相似,1mol CN-中π键数目为______;
③上述沉淀溶解过程的化学方程式为______.
4、选择题 下列有关甲醛分子的说法中正确的是
[? ]
A.C原子采取sp杂化
B.甲醛分子为三角锥形结构
C.C原子采取sp2杂化
D.甲醛分子为平面三角形结构
5、填空题 【二选一-----选修物质结构与性质】
2010年上海世博会场馆,大量的照明材 料或屏幕都使用了发光二极管( LED)。 目前市售LED品片,材质基本以GaAs (砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主。已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图。试回答
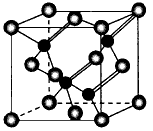
(1)镓的基态原子的电子排布式是_____________。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为__________, 与同一个镓原子相连的砷原子构成的空间构型为__________。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是__________。(用氢化物分子式表示)
(4)砷化镓可由(CH3)3Ga和AsH3在700℃时制得。(CH3)3Ga中镓原子的杂化方式为____________。
(5)比较二者的第一电离能:As__________Ga(填“<”、“>”或 “=")。
(6)下列说法正确的是__________(填字母)。
A.砷化镓晶胞结构与NaCl相同
B.GaP与GaAs互为等电子体
C.电负性:As> Ga
D.砷化镓晶体中含有配位键
(7)写出第IB族元素的价电子排布式:____________________。