1、简答题 欲配制100mL?1.0mol/L?Na2SO4溶液.计算:
①需要Na2SO4质量是多少?
②取出10mL上述溶液,其中含Na+的物质的量为多少?
参考答案:100mL?1.0mol/L?Na2SO4溶液,溶质的物质的量为0.1L×1.0mol/L=0.1mol,
①Na2SO4质量为0.1mol×142g/mol=14.2g,
答:需要Na2SO4质量是14.2g;
②取出10mL上述溶液,溶质的物质的量为0.01L×1.0mol/L=0.01mol,
则n(Na+)=2n(Na2SO4)=2×0.01mol=0.02mol,
答:含Na+的物质的量为0.02mol.
本题解析:
本题难度:一般
2、填空题 当三份铜粉分别与过量的稀硝酸、浓硝酸、热的浓硫酸充分反应后,收集到的气体在相同状况下体积相等时(不考虑NO2转化为N2O4 、生成气体溶解及产生水蒸气的体积),其三份铜的质量比为?
(2)1.28克铜与适量的浓硝酸反应,铜完全溶解,共收集到672 ml NO、NO2混合气(标准状况),则反应中共消耗HNO3的物质的量为?
(3)用20ml 18.4 mol/L浓硫酸和铜共热一段时间后,冷却、过滤,将滤液稀释到100ml,测得溶液中SO42— 的浓度为3.18mol/L,则该溶液CuSO4的物质的量浓度为?
(4)Na2SiO3可以改写成氧化物的形式为Na2O·SiO2,则质量分数为98%的浓硫酸改写成氧化物的形式为?。
参考答案:(11分)(1) 3:1:2?(2)0.07 mol?(3) 0.5 mol/L?(4) SO3·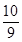 H2O
H2O
本题解析:(1)铜与稀硝酸、浓硝酸和浓硫酸反应的化学方程式分别是3Cu + 8HNO3(稀)=3Cu(NO3)2 + 2NO↑+ 4H2O、Cu + 4HNO3(浓) Cu(NO3)2 + 2NO2↑+ 2H2O、Cu+2H2SO4(浓)
Cu(NO3)2 + 2NO2↑+ 2H2O、Cu+2H2SO4(浓)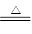 CuSO4+2H2O+SO2↑。当反应中生成当气体体积相等时(假设均是2mol),则根据方程式可知,消耗铜的质量之比是3:1:2。
CuSO4+2H2O+SO2↑。当反应中生成当气体体积相等时(假设均是2mol),则根据方程式可知,消耗铜的质量之比是3:1:2。
(2)1.28g铜的物质的量是1.28g÷64g/mol=0.02mol,则生成硝酸铜就是0.02mol。672 ml NO、NO2混合气(标准状况)的物质的量是0.672L÷22.4L/mol=0.03mol,实验根据氮原子守恒可知,参加反应的硝酸的物质的量是0.02mol×2+0.03mol=0.07mol。
(3)反应前浓硫酸的物质的量是0.02L×18.4mol/L=0.368mol,反应后溶液中SO42-的物质的量是0.10L×3.18mol/L=0.3186mol,则根据S原子守恒可知,反应中生成SO2的物质的量是0.368mol-0.318mol=0.05mol,所以根据电子得失守恒可知,参加反应的铜的物质的量是0.05mol,则硫酸铜的物质的量是0.05mol,其浓度是0.05mol÷0.1L=0.5mol/。
(4)98%的浓硫酸中硫酸和水的物质的量之比是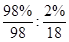 =9:1,由于硫酸可以看作是SO3·H2O,所以98%的浓硫酸改写成氧化物的形式为SO3·
=9:1,由于硫酸可以看作是SO3·H2O,所以98%的浓硫酸改写成氧化物的形式为SO3·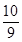 H2O。
H2O。
点评:该题是中等难度的试题,试题基础性强,难易适中,注重解题的灵活性,有利于培养学生的逻辑推理能力和发散思维能力。明确反应的原理并能依据守恒法答题是关键。守恒法是计算题中最常用也是最重要的解题方法,常见守恒法有质量守恒、原子守恒、电荷守恒、电子的得失守恒等,需要平时学习中注意积累和总结。
本题难度:一般
3、选择题 设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4LCCl4含有C-Cl键的数目为4NA
B.常温常压下,44 g由N2O与CO2组成的混合气体含有的氧原子数目为NA
C.反应NH4N3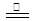 2N2↑+2H2↑,常温常压下每生成22.4LlN2,转移电子的数目为4NA
2N2↑+2H2↑,常温常压下每生成22.4LlN2,转移电子的数目为4NA
D.1 L 1 mol·L-1的AlCl3溶液中含有Cl-的数目为3NA
参考答案:D
本题解析:A中四氯化碳是液体,无法计算其物质的量,错误;B中N2O与CO2的相对分子质量相同,者是44,但含氧原子数应该在NA到2NA之间,错误;C项中不是标准状况下,无法计算其物质的量,错误;D项正确。
本题难度:简单
4、计算题 利用氨氧化法制硝酸,继而制取硝酸铵。若氨氧化法制硝酸的利用率为90%,氨转化为硝酸铵的转化率为94%。则100 t氨最多可生产多少吨硝酸铵?
参考答案:100 t氨最多可生成216.4 t硝酸铵。
本题解析:氨氧化法制硝酸的反应为:
4NH3+5O2 4NO+6H2O
4NO+6H2O
2NO+O2=2NO2
4NO2+2H2O+O2=4HNO3
所以氨氧化制硝酸的关系式为:
NH3~NO~NO2~HNO3(NH3全部转化为HNO3)
设生产硝酸的质量为x,用于生成HNO3的NH3质量为y生成NH4NO3的质量为z
NH3~NO~NO2~HNO3
17 63
y×90% x
y=
? NH3+HNO3=NH4NO3
17 63 80
 ×94% x z
×94% x z
则17∶ =63∶x
=63∶x
x≈170.4 t
又63∶x=80∶z
z= =
= ≈216.4 t
≈216.4 t
本题难度:一般
5、选择题 NA为阿伏加德罗常数,下列叙述中正确的是 ( )
①106 g Na2CO3晶体中的离子总数大于3NA
②标准状况下,16 gO3和O2混合气体中含有的氧原子数为NA
③将0.1mol NaCl全部溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1NA
④1 mo1 N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数大于2NA
A.①②
B.②④
C.①③
D.③④