1、填空题 氮是地球上含量丰富的原子元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)25℃时,0.1mol/LNH4NO3溶液中水的电离程度?(填“大于”、“等于”或“小于”) 0.1mol/L NaOH溶液中水的电离程度。
(2)若将0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合,混合溶液中2c(NH4+)>c(NO3-),所得溶液中离子浓度由大到小的顺序是?。
(3)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。经测定16g气体在上述反应中放出284kJ的热量。则该反应的热化学方程式是?。
(4)下图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图。
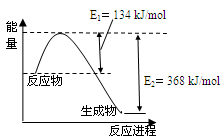
已知:N2(g)+O2(g)=2NO(g)?△H=+180kJ/mol
2NO (g)+O2(g)=2NO2(g)?△H=-112.3kJ/mol
则反应:2NO(g)+2CO(g) N2(g)+2CO2(g)的△H是?。
N2(g)+2CO2(g)的△H是?。
参考答案:(1)大于?(2)c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)
(3)2N2H4(g)+2NO2(g)=3N2(g)+2H2O (g)?△H=-1136kJ/mol(4)-760.3kJ/mol
本题解析: (1)酸、碱抑制水的电离、能水解的盐促进水的电离。
(2)0.1mol/L NaOH溶液和0.2mol/LNH4NO3溶液等体积混合后c(Na+)=0.05mol/L、c(NO3-)=0.1mol/L,由2c(NH4+)>c(NO3-)得c(NH4+)>0.05mol/L。电荷守恒式为c(Na+)+c(NH4+)+c(H+)=c(NO3-)+c(OH-),由c(Na+)、c(NO3-)、c(NH4+)得c(OH-)>c(H+)。所以c(NO3-)>c(NH4+)>c(Na+)>c(OH-)>c(H+)。
(3)2N2H4+2NO2=3N2+2H2O,16gN2H4为0.5mol,所以2molN2H4反应放热1136kJ。
(4)由图像可得NO2(g)+CO(g) CO2(g)+NO(g)?△H=-234kJ/mol。由盖斯定律得2NO(g)+2CO(g)
CO2(g)+NO(g)?△H=-234kJ/mol。由盖斯定律得2NO(g)+2CO(g) N2(g)+2CO2(g)的△H=-(234×2+180+112.3)kJ/mol=-760.3kJ/mol。
N2(g)+2CO2(g)的△H=-(234×2+180+112.3)kJ/mol=-760.3kJ/mol。
本题难度:一般
2、选择题 物理和化学变化通常包含结构和能量的改变,下列相关过程的结构、能量变化叙述正确
的是
A.有化学键断裂的过程一定是化学变化
B.化学变化中的能量变化一定是由化学键断裂、生成引起的
C.同一化学反应,只要起始和终止状态和量相同,加催化剂后,反应总的热效应一定不
会发生改变
D.放热反应一定都是自发进行的反应,吸热反应一定都是非自发进行的反应
参考答案:C
本题解析:A、电解质的电离、离子晶体的熔化,有化学键断裂但属于物理变化,错误;B、分子晶体中分子间作用力的变化也会造成能量变化,错误;C、反应总的热效应只与起始和终止状态有关,与催化剂无关,正确;D、反应是否自发是?H和?S共同作用的结构,错误。
本题难度:一般
3、选择题 下列说法正确的是( )
A.含有共价键的化合物必是共价化合物
B.阴、阳离子间通过静电引力所形成的化学键是离子键
C.液态氯化氢中存在H+和Cl-,所以能导电
D.化学变化过程,一定会破坏旧的化学键,同时形成新的化学键
参考答案:D
本题解析:A、有的离子化合物也有共价键,故错;B、阴、阳离子间通过静电作用所形成的化学键是离子键,故错;C、液态氯化氢中存在的是HCl分子,故错。故选D。
点评:本题考查了化学键的概念,难度不大,明确相邻的两个或多个原子之间的强烈的相互作用才是化学键,不相邻的原子之间的作用力不是化学键。
本题难度:一般
4、选择题 已知热化学方程式:2H2(g)+O2(g)=2H2O(g) ΔH1=-483.6kJ/mol,则对于热化学方程式:2H2O(l)=2H2(g)+O2(g) ΔH2=b,下列说法正确的是[ ]
A.该反应的ΔH2=+483.6kJ/mol
B.|ΔH2|<|ΔH1|
C.|ΔH2|>|ΔH1|
D.热化学方程式中化学计量数表示分子个数