1、简答题 用黄铜矿(主要成分是CuFeS2)炼制粗铜主要有三个阶段:①将黄铜矿的精矿送入沸腾炉,在923~1073K条件下通空气进行焙烧,得到焙砂(主要成分是Cu2S、FeS)和废气;?②将焙砂送入反射炉进行高温熔炼制成冰铜(冰铜可看作由Cu2S和FeS组成);?③将冰铜送入转炉并在高温下吹入空气,在此阶段,Cu2S先变为Cu2O,Cu2O再与Cu2S反应生成Cu,FeS变为FeO.试回答下列问题:
(1)为防止污染环境,沸腾炉和转炉产生的废气用于制取______
(2)为加快黄铜矿的焙烧速率,可采取的措施有(写出两种)______
(3)写出Cu2O与Cu2S反应生成Cu的化学方程式______
(4)写山FeO与足量稀硝酸反应的离子方程式______
(5)从整个过程来看,CuFeS2最终变为Cu、FeO和SO2,则1mol?CuFeS2完全反应总共消耗标准状况下空气______L(空气中氧气所占的体积分数按20%计算).
参考答案:(1)沸腾炉和转炉产生的废气主要是二氧化硫,可以用来获得硫酸,故答案为:硫酸;
(2)增大固体接触面积,升高温度,增大空气流速即增大氧气浓度均能加快化学反应速率,故答案为:将黄铜矿粉碎,增大空气流速,升高温度等;
(3)Cu2O与Cu2S反应生成Cu和二氧化硫,化学方程式为:Cu2O+2Cu2S?高温?.?6Cu+SO2↑,故答案为:Cu2O+2Cu2S?高温?.?6Cu+SO2↑;
(4)氧化亚铁可以和硝酸反应体现了硝酸的酸性和氧化性,硝酸能将亚铁离子氧化为最高价三价铁离子,即3FeO+NO3-+10H+=3Fe3++NO↑+5H2O,
故答案为:3FeO+NO3-+10H+=3Fe3++NO↑+5H2O;
(5)从整个过程来看,CuFeS2最终变为Cu、FeO和SO2,即2CuFeS2+5O2=2Cu+4SO2+2FeO,则1molCuFeS2完全反应消耗氧气的物质的量是2.5mol,体积是2.5mol×22.4L/mol=56L,需要空气的体积是56L20%=280L.故答案为:280.
本题解析:
本题难度:一般
2、选择题 为比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下: 能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有
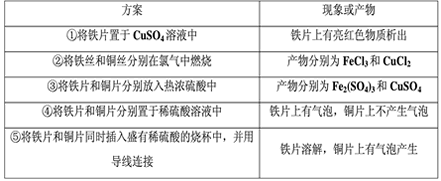
[? ]
A.2种
B.3种
C.4种
D.5种
参考答案:B
本题解析:
本题难度:一般
3、选择题 下列物质间的转化可由一步反应完成的是( )
A.SiO2→H2SiO3
B.Cu(OH)2→Fe(OH)3
C.CaCO3→Na2CO3
D.Zn→ZnSO4
参考答案:D
本题解析:
本题难度:一般
4、选择题 实验室常用硫酸铜溶液吸收气体中的硫化氢:CuSO4+H2S=CuS↓+ H2SO4,由该反应可以推测
[? ]
A. CuS易水解
B. CuS可溶于盐酸
C. 相同温度下氢硫酸饱和溶液中硫离子(S2-)浓度比CuS饱和溶液中大
D. 强酸可以制取弱酸
参考答案:C
本题解析:
本题难度:简单
5、选择题 在CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化。根据上述现象,确定下面结论正确的是
[? ]
A.不溶物一定是Cu
B.不溶物一定含铜,但不一定含铁
C.不溶物一定是Fe
D.溶液中一定含有Fe2+,但不一定含有Cu2+
参考答案:B
本题解析:
本题难度:一般