| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《影响化学反应速率的因素》高频考点特训(2019年练习版)(九)
(Ⅱ)若该密闭容器中加入的是2 mol Fe(s)与1 mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35 mol。 (1)t1~t2这段时间内的化学反应速率v(H2)= 。? (2)若继续加入2 mol Fe(s),则平衡 移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1 mol H2O(g),再次达到平衡后,H2物质的量为 mol。? (3)该反应的逆反应速率随时间变化的关系如图。t1时改变了某种条件,改变的条件可能是 、 (填写2项)。? 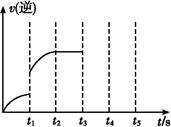 2、实验题 草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快。某学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究。
实验Ⅱ:另取2支试管分别加入5 mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1 mol·L-1 KMnO4溶液。记录溶液褪色时间,如表2:
实验Ⅲ:另取3支试管分别加入5 mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1 mL、2 mL稀硫酸溶液,再各加入5滴0.1 mol·L-1 KMnO4溶液,然后置于温度为65℃的水浴中加热。记录溶液褪色时间,如表3:
(1)实验Ⅰ得出的结论是_____。 (2)比较实验Ⅱ、Ⅲ得出的结论正确的是:_____。 ①温度对该反应速率有影响 ②硫酸对草酸和KMnO4溶液的反应有影响 ③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小 ④在酸性范围内,pH值越小对反应越有利[ (3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:____。实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色_____,且30 s不改变。滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度____(选填:偏大、偏小、无影响)。 (4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为: 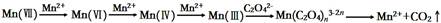 上述实验中,实验_____可证明这个历程是可信的。 3、选择题 在一固定体积的密闭容器中,充入2molA和1molB,发生如下反应:2A(g) + B(g) 4、选择题 下列实验中,可以加快反应速率的是:(? ) 5、填空题 (8分)在体积不变的密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应: |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《有关氧化还.. | |