1、填空题 氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有 性,请写出工业上用氯气与NaOH溶液反应生产消毒剂NaClO的离子方程式 。
(2)棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O和NaHCO3的离子方程式 。
(3)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为 。
②ClO2遇浓盐酸会生成Cl2,每生成1 mol Cl2转移电子的物质的量为 。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为 。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
已知:①上述反应中,4 mol HCl被氧化放出115.6 kJ的热量。

则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”) 。
2、填空题 (16分)NH3能被O2氧化生成NO,进而氧化成NO2,用来制造硝酸;将NO2(g)转化为N2O4(l),再制备浓硝酸。
(1)2NO(g)+ O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率的不同压强(P1、P2)下随温度变化的曲线如图。

①P1______(填“>”或“<”)P2
②随温度升高,该反应平衡常数变化的趋势是____________。
(2)已2NO2(g) N2O4(g) △H1<0
N2O4(g) △H1<0
2NO2(g) N2O4(l) △H2<0
N2O4(l) △H2<0
下列能量变化示意图中,正确的是_______(填序号)

(3)50℃时在容积为1.0L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
2NO2(g),随着反应的进行,混合气体的颜色变深。达到平衡后,改变反应 温度T,10s后又达到平衡,这段时间内,c(N2O4)以0.0020mol/(L·s)的平均速率降低。
①50℃时,体系中各物质浓度随时间变化如图所示。在0~60s 时段,反应速率v(NO2)为_________mol/(L·s)。
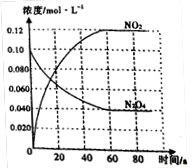
②T______(填“>”或“<”) 50℃。
③计算温度T时该反应的平衡常数K(写出计算过程)。
(4)科学家正在开发以氨代替氢气的新型燃料电池有许多优点;制氨工业基础好、技术成熟、成本低、储运方便等。直接供氨式碱性(KOH)燃料电池的总反应为:4NH3+3O2==2N2+6H2O,氨气应通入_______(填“正极”或“负极”)室,正极反应式为_____________________________
3、填空题 (12分)(1)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知: C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);ΔH1=-Q1 kJ/mol,C2H5OH(g)=C2H5OH
(l);ΔH2=-Q2 kJ/mol,H2O(g)=H2O(l);ΔH3=-Q3 kJ/mol。若使23g液态无水酒精完全
燃烧,并恢复到室温,则整个过程中放出的热量为 ________________ kJ。
(2)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内
熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:

①右图是一定量丙烷完全燃烧生成CO2和1mol H2O(l)过程中的能量变化图,请写出表示丙烷燃烧热的热化学方程式 。
②近年来已经研制出丙烷燃料电池,该电池的电解质溶液为KOH溶液,写出该电池负极的电极反应式:__________________________________________。
③某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出 3360ml(标准状况)氧气体,阴极析出金属 10.4 g,在该含氧酸盐中金属的化合价为 ____ ,在该实验中,若不考虑能量的损失,电池中消耗丙烷的质量最少是 __ g(结果精确至0.01 g)。
4、选择题 已知25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol-1、285.8 kJ·mol-1、
890.3 kJ·mol-1、2 800 kJ·mol-1,则热化学方程式正确的是
[? ]
A.C(s)+1/2O2(g)====CO(g) ΔH=-393.5 kJ·mol-1
B.2H2(g)+O2(g)====2H2O(g) ΔH=+571.6 kJ·mol-1
C.CH4(g)+2O2(g)====2H2O(g)+CO2(g) ΔH=-890.3 kJ·mol-1
D.1/2C6H12O6(s)+3O2(g)====3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
5、选择题 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种反应原理如下:
CH3OH(g) + H2O(g) → CO2(g) + 3H2(g)