|
高中化学知识点归纳《热化学方程式》试题特训(2019年最新版)(八)
2019-07-03 23:55:50
【 大 中 小】
|
1、选择题 已知下列热化学方程式:
Zn(s)+O2(g)=ZnO(s) ΔH=-Q1 kJ / mol
Hg(l)+O2(g)=HgO(s) ΔH=-Q2kJ / mol
Zn(s)+HgO(s)=Hg(l) +ZnO(s) ΔH=-Q3kJ / mol
Q3值为
A.Q2 - Q1
B.Q1+ Q2
C.Q1- Q2
D.-Q1- Q2
|
参考答案:C
本题解析:根据盖斯定律,一式减二式得Zn(s)+HgO(s)=Hg(l) +ZnO(s)的焓变ΔH=-Q3 kJ / mol =(-Q1+Q2)kJ / mol,Q3= Q1- Q2,选C。
考点:考查盖斯定律的应用。
本题难度:一般
2、简答题 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)
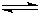
CH3OH(g)
根据题意完成下列各题:反应达到平衡时,
(1)平衡常数表达式K=______,升高温度,K值______(填“增大”、“减小”或“不变”).
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______(用?nB?tB?表示)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的 ,下列有关该体系的说法正确的是______
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:______(用化学方程式表示).
(5)使用燃料电池是节能减排的重要手段之一.CO和H2(俗称水煤气)燃料电池就是其中的一种,该电池的两极分别通入燃料气(水煤气)和氧气.电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.水煤气在一定条件下可以合成二甲醚,同时还产生一种可以参与大气循环的无机化合物,3CO+3H2=CH3OCH3+CO2?或?2CO+4H2=CH3OCH3+H2O.上述水煤气燃料电池的负极反应方程式:(写1个)______.
(6)如图是丙烷、二甲醚燃烧过程中能量变化图,其中x为各自反应中对应的系数.根据该图写出二甲醚燃烧的热化学方程式:______


参考答案:(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,根据反应方程式可知,平衡常数为K=c(CH3OH)c(CO)?c2(H2),由图象可知,当温度升高时,甲醇的物质的量减小,说明升高温度平衡向逆反应方向移动,则平衡常数减小,
故答案为:K=c(CH3OH)c(CO)?c2(H2);?减小;
(2)由图象可知,时间达到tB时,甲醇的物质的量为nB,则甲醇的反应速率为v(CH3OH)=nB3tBmol?(L?min)-1,由方程式可知v(H2)=2v(CH3OH)=2nB3tBmol?(L?min)-1,
故答案为:2nB3tBmol?(L?min)-1;
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的12,体系的压强增大,正逆反应速率增大,平衡向正反应方向移动,甲醇的物质的量增加,由于温度不变,则平衡常数不变,达新平衡时,虽然氢气反应一部分,但由于体积的影响大于平衡移动的影响,则氢气的浓度增大,
故答案为:bc;
(4)Cu2O能被CO还原生成CO2和Cu,该反应为可逆反应,反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,反应为Cu2O+CO

2Cu+CO2,
故答案为:Cu2O+CO

2Cu+CO2;
(5)CO和H2都具有还原性,为燃料电池的负极,被氧化失去电子生成CO2和H2O,电极反应为CO+O2--2e-=CO2,或H2+O2--2e-=2H2O,
故答案为:CO+O2--2e-=CO2,H2+O2--2e-=2H2O;
(6)由图象可知生成1mol水时,二甲醚燃烧放出485KJ的热量,则生成3mol水,放出的热量为3×485KJ=1455KJ,
所以热化学方程式为CH3OCH3(g)+3O2(g)点燃
本题解析:
本题难度:一般
3、填空题 Ⅰ(8分)为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:

(1)该反应为____________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量____________(填
“高”或“低”)。
(3)物质中的化学能通过化学反应转化成______释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
(5)写出一个符合题中条件的化学方程式:_____________________________________
Ⅱ.同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(白磷,s)+5O2(g) ====P4O10(s) ΔH=-2 983.2 kJ·mol-1 ①
P(红磷,s)+  O2(g)="===" O2(g)="==="  P4O10(s) ΔH=-738.5 kJ·mol-1 ② P4O10(s) ΔH=-738.5 kJ·mol-1 ②
则白磷转化为红磷的热化学方程式为____________。相同状况下,能量状态较低的是____________;白磷的稳定性比红磷____________(填“高”或“低”)。
参考答案:Ⅰ (1)放热 (2)高 (3) 热能 (4)低 (5)2Al+6HCl===2AlCl3+3H2↑(或2Na+2H2O===2NaOH+H2↑或NaOH+HCl===NaCl+H2O等合理答案均可)
ⅡP4(白磷,s)====4P(红磷,s);ΔH=-29.2 kJ· mol-1 红磷 低
本题解析:I(1)U形管中甲处液面下降乙处液面上升,说明该反应放热,温度升高,瓶内的压强增大;
(2)根据化学反应与能量的关系判断放热反应是反应物的总能量高于生成物的总能量,所以A和B的总能量比C和D的总能量高;
(3)温度升高,说明物质中的化学能通过化学反应转化成热能释放出来;
(4)反应热=反应物的总键能-生成物的总键能,该反应放热,说明反应物的总键能低于生成物的总键能;
(5)放热反应的例子有燃烧反应、活泼金属与酸的反应、中和反应等,举一例即可;
II根据盖斯定律可知,白磷转化为红磷的热化学方程式=①-4②,即P4(白磷,s)====4P(红磷,s);ΔH=(-2 983.2 kJ·mol-1)-4×(-738.5 kJ·mol-1)=-29.2 kJ· mol-1;该反应是放热反应,说明红磷的能量低于白磷,所以白磷的稳定性比红磷低。
考点:考查化学反应与能量的关系,反应热与键能的关系,物质稳定性的判断
本题难度:一般
4、选择题 已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g) △H= +255.6kJ·mol-1
b.CH3CH2OH(g)+1/2O2(g)==3H2(g)+2CO(g) △H= +13.8kJ·mol-1
则下列说法不正确的是
[? ]
A.降低温度,可提高b路线中乙醇的转化率
B.从能量消耗的角度来看,b路线制氢更加有利
C.乙醇可通过淀粉等生物原料发酵制得,属于可再生资源
D.由a、b知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
参考答案:A
本题解析:
本题难度:一般
5、选择题 已知:

C3H8(g)+5O2(g)===3CO2(g)+4H2O(1) △H1
H2O(1)=H2O(g) △H2
C3H8(g)+5O2(g)===3CO2(g)+4H2O(g) △H3
则三反应热之间的关系正确的是( )
参考答案:A
本题解析:根据盖斯定律可知,①+②×4即得到C3H8(g)+5O2(g)===3CO2(g)+4H2O(g),所以
本题难度:一般
| 
